
Gießener Pseudo-Diagnostik
Kommentar zu einer aktuellen Arbeit von Schneck et al. [2].
Prinzipielles
Grundsätzlich erfolgt die Diagnostik derjenigen Messwerte, die sich während der Lungenpassage des Blutes verändern, im arteriellen Blut, um auf diese Weise die Versorgung aller Organe zu beurteilen. Dies gilt für den Sauerstoff- (pO2, sO2) und den Säure-Basen-Status (pCO2, pH). Eine Diagnostik im venösen Blut der Organe ist deshalb wenig hilfreich, weil diese von Organ zu Organ, je nach Durchblutung und Metabolismus des Organs (O2-Verbrauch, CO2-Produktion) sehr unterschiedlich ausfällt. Als Ausnahme von dieser „Regel“ können die NIRS (Near Infrared Spectroskopy) des Gehirns oder die AiDCO2 (alveolo-inramukosale CO2-Partialdruck-Differenz) betrachtet werden, wenn ein typisches Organ (Gehirn, Magenmukosa) als repräsentativ für den Gesamt-Organismus betrachtet werden soll.
- Eine so genannte Blutgas-Analyse (BGA), gemeint sind Säure-Basen- und Sauerstoff-Status, aus dem venösen Blut vorzunehmen, ist leider Mode geworden, so auch in dieser Arbeit [2] „Das Monitoring der Elektrolyte und Blutgase wurde mit einer gut aspirablen peripheren Venenverweilkanüle gesichert und anschließend durchgeführt (s. Tab. 1).“ Mode deshalb, weil dieses Vorgehen gerade in jüngster Zeit häufiger publiziert wird [1, 3].
Diese Diagnostik ergibt natürlich keinerlei Sinn, weil die Werte von pH und pCO2 (SB-Status) sowie pO2 und sO2 (O2-Status) vor der Lunge bzw. nach dem Arm (z. B. Vena cubitalis) keine diagnostische Relevanz besitzen. Nach der Lunge hingegen kann so die Lungenfunktion über das arterialisierte Blut überprüft werden. - Im gleichen Sinne wird auch das Puls-Oxymeter eingesetzt: Für einen kurzen Augenblick des Einströmens von arteriellem Blut mit dem Puls am Finger wird nicht die lokale (langweilige) O2-Sättigung sondern die arterielle O2-Sättigung bestimmt, daher die Bezeichnung Puls-Oxymeter.
- Auch das Kapnometer folgt dem gleichen Ansatz: Der arterielle paCO2 kann mit guter Näherung aus dem (maximalen) end-exspiratorischen, d. h. alveolären pACO2, ermittelt werden. Der paCO2 soll sich nach der Lungen-Passage dem pACO2 der Alveolen angeglichen (äquilibriert) haben.
Alle Messwerte, die sich während der Lungenpassage nicht verändern können, dürfen natürlich auch aus dem venösen Blut bestimmt werden, zum Beispiel die Elektrolyt-Konzentrationen.
Dies gilt auch für den Base Excess (BE, mmol/l), der sich ja während der Lungenpassage nicht verändern kann, auch wenn sich die Messwerte, die für seine Berechnung eingesetzt werden (pCO2, sO2 und pH), deutlich ändern: BE vor der Lunge = nach der Lunge. Wird die richtige Berechnungsformel dazu verwendet, wie unter Korrekte Berechnung des BE beschrieben, gelingt dies nachweislich.
„Lehrbeispiel zur Physio- und Pathophysiologie des Elektrolythaushalts“
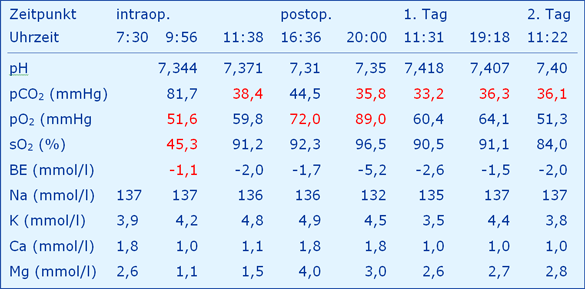
Die Autoren beschreiben zu dieser Thematik das so genannte Gitelman-Syndrom, das aus dem Symptomenkomplex Hypomagnesiämie, Hypokaliämie, Hypokalzurie und metabolische Alkalose bestehen soll. Sie stellen dazu einen Patienten vor, der seit vielen Jahren mit einer patientengesteuerten Magnesiumpumpe versorgt wird. Seine Daten des Säure-Basen- und Elektrolytstatus – aus dem venösen Blut – sind in einer Tabelle dargestellt, die hier wiedergegeben und kommentiert wird, und zwar in der Reihenfolge venöses Blut, metabolische Alkalose, Hypokalzurie, Hypokaliämie und Hypomagnesiämie.
Kommentare zu den Befunden
Venöses Blut
Typische Messwerte des Blutes aus der Cubitalvene sind ein pO2 von ca. 25 - 30 mmHg mit einer zugehörigen sO2 von ca. 50 % (Korrekte Berechnung des BE), der pCO2 beträgt ca. 50 mmHg und der zugehörige pH dann ca. 7,35.
Um 9.56 Uhr dürfte eine typische venöse Blutprobe untersucht worden sein, allerdings mit einem auffallend hohen pCO2 von 81,7 mmHg, vielleicht aus einem lange gestauten Arm entnommen. Der pO2 von 51,6 mmHg passt allerdings nicht zu einer sO2 von 45,3 %, wie an der Kombination von 11.22 Uhr am 3. postoperativen Tag zu sehen ist (51,3 mmHg ergibt eine realistische sO2 von 84 %).
Von zwei Ausnahmen abgesehen sind die Werte des pCO2 unrealistisch niedrig, sie können nicht unter dem arteriellen Normalwert von 40 mmHg liegen, es sei denn, der Patient sei sehr stark hyperventiliert worden (paCO2 ca. 25 mmHg).
Die Werte des pO2 mit 72,0 bzw. 89,0 mmHg sind unrealistisch hoch, es sei denn der Patient sei über die ganze Zeit mit einer FIO2 von angenähert 1,0 beatmet worden (paO2 500 - 650 mmHg).
Metabolische Alkalose
In der ganzen Arbeit findet sich kein Hinweis auf die angeblich typische metabolische Alkalose, allerdings ergibt der aus pH 7,344 und pCO2 81,7 mmHg ermittelte BE nicht -1,1 sondern +12,0 mmol/l, also eine sehr deutliche metabolische Alkalose.
Hypokalzurie
Angaben über die Kalzium-Konzentration im Urin fehlen, bei den Konzentrationen im Blut kann man nur spekulieren, dass es sich um die Konzentrationen des ionisierten Kalziums handelt, üblicherweise mit Ca2+ bezeichnet. Dann allerdings wäre der Ausgangswert mit 1,8 mmol/l sehr hoch.
Hypokaliämie
Zeichen einer Hypokaliämie fehlen gänzlich, vielleicht auf die sporadische orale Gabe von Kalinor-Brause-Tabletten zurückzuführen.
Hypomagnesiämie
Auch hier wird unterstellt, dass es sich bei den Angaben um das ionisierte Magnesium im Plasma handelt (nicht Blut), üblicherweise mit Mg2+ bezeichnet.
Fazit
Eine Diagnostik des Säure-Basen (pH, pCO2) sowie O2-Status (pO2, sO2) aus dem peripher-venösen Blut, also vor der Lunge, ergibt keinen Sinn. Die Angaben der Autoren zum Säure-Basen- und Elektrolyt-Status dieses Patienten sind unphysiologisch und daher als „Lehrbeispiel zur Physiologie und Pathophysiologie des Elektrolythaushalts“ vollkommen ungeeignet.
Literatur
- Schaden E, Wetzel L, Kozek-Langenecker S et al.:
Effect of the carrier solution for hydroxyethyl starch on platelet aggregation and clot formation.
Br J Anaesth 2012; 109: 572 - 577 - Schneck E, Schaumberg S, Koch C, Rickert M, Lichtenstern C:
Anästhesiologisches Management des Gitelman-Syndroms.
Lehrbeispiel zur Physio- und Pathophysiologie des Elektrolythaushalts.
Anaesthesist 2013; 62: 728 - 733 - Story DA, Lees L, Weinberg L et al.:
Cognitive changes after saline or Plasmalyte infusion in healthy volunteers: A multiple blinded, randomized, cross-over trial.
Anesthesiology 2013; 119: 569 - 575
Anmerkung
Für eine Kooperation an dieser Stelle waren die Autoren leider nicht zu gewinnen, der korrespondierende Autor (C. Lichtenstern): Wir sind gerne bereit auf Ihren Kommentar im "Anaesthesisten" zu antworten.
