
Entscheidungshilfe Infusionslösungen 2009/2012
Für jede intravenöse Flüssigkeitszufuhr, sei es zur Normalisierung des intravasalen Blutvolumens (IVFV) oder zur Therapie des extrazellulären Flüssigkeitsvolumens (ECFV), sollten möglichst physiologische Lösungen (iso-ionisch) mit allen osmotisch wirksamen Komponenten (iso-ton) zum Einsatz kommen, ohne den Säure-Basen-Status des Patienten zu stören (iso-hydrisch). Soll eine Hypovolämie zur Sicherung von Hämodynamik und Vitalfunktionen behoben werden, muss eine kolloidale Lösung (iso-onkotisch) verwendet werden, der Versuch, dieses mit einer kristalloiden Flüssigkeit zu erreichen, erfordert das 5-fache an Volumen, weil nur ca. 20 % dieser Lösung im IVFV verbleiben. Folglich kann für ein optimales "Fluid-Management", also intravasaler Volumen- oder extrazellulärer Flüssigkeitsersatz, nur eine so genannte balancierte Lösung in Frage kommen: Balanciert steht hier für "möglichst physiologisch", anders formuliert, mit möglichst viel "iso".
Deklarierung
Infusionslösungen sollten generell so deklariert werden, dass der Anwender bzw. Arzt möglichst einfach, aber trotzdem umfassend über den Inhalt informiert wird. Die vom Gesetz geforderte Deklarierung der Zusammensetzung über die Einwaage (Gewicht) bei Herstellung ist praktisch uninteressant, weil diese etwas vortäuschen kann, was die Lösung nicht (mehr) enthält. Als Beispiel sei das ursprünglich eingewogene Bikarbonat (HCO3) erwähnt, das längst als CO2 entwichen ist [Zander 1993]. Die Zusammensetzung der fertigen Lösung im Behältnis in vitro (g/l oder mmol/l) ist dann uninteressant, wenn die Wirkung im Patienten eine andere ist. Relevant für den Anwender ist daher die mit der Lösung beim Patienten (in vivo) erzeugte Wirkung, was an zwei Beispielen erläutert werden soll.
Isoton ist eine Lösung dann, wenn ihre berechnete in vivo Osmolalität einen Wert von 290 mosmol/kg H2O aufweist, in vivo bedeutet hier nach Infusion und möglicher Metabolisierung der Inhaltsstoffe: Eine 5%ige Glukose-Lösung zeigt bei der Messung der Osmolalität einen normalen Wert (~ 290 mosmol/kg H2O), nach schneller Metabolisierung der Glukose aber entspricht die Wirkung dieser Lösung der von reinem Wasser.
Iso-hydrisch, also ohne Einfluss auf den Säure-Basen-Status des Patienten, ist eine Bikarbonat-freie Lösung dann, wenn der Zusatz von 24 mmol/l Azetat im Patienten zu einer Freisetzung von 24 mmol/l HCO3 geführt hat. Der BE dieser Lösung in vitro beträgt - 24 mmol/l, die Lösung säuert an, der potentielle Base Excess (BE) dieser Lösung in vivo hingegen beträgt 0 mmol/l, die Lösung hat keinen Einfluss auf den Säure-Basen-Status. Hier wird in beiden Fällen so verfahren, auch wenn die Hersteller, den gesetzlichen Vorschriften folgend, ihre Lösungen anders deklarieren.
Entscheidungshilfen
In der Reihenfolge ihrer Bedeutung für den Patienten sollte eine Infusionslösung nach
- dem potentiellen BE der Lösung (0 ± 10 mmol/l),
- der in vivo Osmolalität (290 ± 10 mosmol/kg H2O), dem
- Elektrolytmuster (Na, K, Cl), einschließlich Ca2+-Konzentration, und
- dem kolloid-osmotischen Druck
beurteilt werden.
Potentieller BE
Lösungen ohne die physiologische Pufferbase Bikarbonat erzeugen beim Patienten eine Verdünnungs- bzw. Dilutionsazidose, Azetat als Bikarbonat-Ersatz gilt heute als erste Wahl, während Laktat als metabolisierbares Anion abzulehnen ist (Verhinderung der Laktat-Diagnostik, Steigerung von O2-Verbrauch und Glukoneogenese mit Hyperglykämie beim Diabetiker, Wirkungsverlust im Schock, Ca-Bindung). Eine Lösung mit einem BEpot von 0 ± 10 mmol/l wäre optimal. Im Falle einer Volumentherapie bei größerer Blutung, z. B. beim Polytrauma, ist das oberste Ziel, jede Azidose zu vermeiden, was bei der Hämotherapie (EK's) kaum zu erfüllen ist.
Die optimale Volumentherapie verhindert über die Azidose-Vermeidung eine Koagulopathie, die zusammen mit der Hyopthermie die letale Trias des Trauma-Patienten bildet (vergl. hierzu Größere Blutung – Azidose verhindern!).
Hypotone Lösungen sind obsolet
Da alle Körperflüssigkeiten des Organismus den gleichen osmotischen Druck wie das Plasma besitzen, charakterisiert durch den Wert der Osmolalität, kann die Infusion einer hypertonen Lösung zu einer Wasserverschiebung aus dem Intra- in den Extrazellularraum führen, eine hypotone Lösung umgekehrt zu einer Wasserverschiebung in den Intrazellularraum. Dieser zweite Fall wird zunehmend kritisch betrachtet, weil viele der in täglicher klinischer Praxis eingesetzten Infusionslösungen hypoton sind. Dazu zählen vor allem Ringer-Laktat bzw. -Azetat mit 256 mosmol/kg H2O (anstatt 288), die zu einer Wasseraufnahme der Organe führen können, ohne dass dies besondere Folgen hätte.
Als kritische Ausnahme aber ist das Gehirn (ZNS) anzusehen. Der in seiner Form nicht veränderbare Schädel beinhaltet drei inkompressible Flüssigkeitsräume, von denen zwei, nämlich Blut und Liquor, partiell nach außen verschoben werden können: 1340 ml (g) Gehirn, 120 ml Blut, 140 ml Liquor. Jede Volumen-Änderung eines der drei Kompartimente muss mit einer identischen Änderung eines anderen Raumes beantwortet werden (Hirnödem, intrazerebrale Blutung, subdurales Hämatom, Tumor etc.). Eine Abnahme der Plasma-Osmolalität um ca. 3 %, z. B. von 288 auf 280 mosmol/kg H2O, muss zu einer Zunahme des Gehirnvolumens um ebenfalls 3 % führen, was eine Abnahme des Blut- und/oder Liquor-Volumens um beträchtliche etwa 30 % bedingt. Es ist lange bekannt, dass größere Volumina von Ringer-Laktat einen vorübergehenden Anstieg des ICP verursachen, allerdings nicht so stark wie nach Infusion größerer Volumina 5 %iger Glukose-Lösung.
Daraus ist der Schluss zu ziehen: Die Infusion größerer Volumina hypotoner Lösungen ist zu vermeiden, insbesondere bei intrakraniell raumfordernden Prozessen, isotonen Lösungen ist daher in jedem Fall der Vorzug zu geben.
Dies gilt insbesondere für die Pädiatrie: Die Diskussion über eine optimale isotone Infusionslösung für die Pädiatrie mündete 2007 in ein Editorial [Lönnqvist 2007], in dem eine isotone Lösung mit einer Natrium-Konzentration sehr nah am Plasmawert und einem Glukose-Zusatz gefordert wurde. Diese Arbeit endet mit einem Appell: "Medical companies, please provide us with this special perioperative infusion fluid as it will definitely have the potential of saving lives!" Die empfohlene "golden compromise solution" mit 0,9% Glukose und 120 mmol/l NaCl wird allerdings nicht akzeptiert, stattdessen wird 2008 eine "narrensichere" ('fool proof') Lösung vorgeschlagen [Sümpelmann et al. 2008]: Eine isotone Lösung mit einem möglichst physiologischen Elektrolytmuster, einem Zusatz von Azetat statt Laktat und einer Glukosekonzentration von 1 %.
Normales Elektrolytmuster (Isoionie)
Das physiologische Elektrolytmuster des Plasmas ist weitgehend nachzubilden, und zwar die Kationen entsprechend ihrer Bedeutung Natrium, Kalium, Kalzium und das Anion Chlorid. Wenn die Natrium-Konzentration einer balancierten Lösung 138–146 mmol/l beträgt, wird die normale Plasma-Konzentration mit 142 mmol/l ausreichend abgebildet. Die normale Plasma-Kalium-Konzentration beträgt 4,5 mmol/l, woraus eine Kalium-Konzentration für eine balancierte Lösung von 4–5 mmol/l abgeleitet wird.
Hyperchlorämie vermeiden
Die normale Plasma-Konzentration beträgt 103 mmol/l, die im Idealfalle in einer balancierten Lösung mit 100–106 mmol/l nachgebildet wird, was allerdings nur schwer zu erfüllen ist.
Zum Vergleich: Die klassische, so genannte physiologische NaCl-Lösung (0,9 g/dl) hat mit 154 mmol/l Natrium und 154 mmol/l Chlorid viel zu hohe Konzentrationen. Eine Ringer-Laktat-Lösung hat mit 130 mmol/l eine zu niedrige Natrium- und mit 112 mmol/l eine zu hohe Chlorid-Konzentration. Argumente gegen eine zu hohe Chlorid-Konzentration einer Infusionslösung gibt es zahlreich. Aus verschiedenen Untersuchungen an Tier und Mensch kann abgeleitet werden, dass eine Hyperchlorämie des Extrazellularraumes, nicht die Hypernatriämie, eine spezifisch renale Vasokonstriktion mit Abnahme der glomerulären Filtrationsrate, also der Diurese, verursacht. Schon eine Hyperchlorämie um 12 mmol/l (auf 115 mmol/l) führt zu einer Zunahme des renalen Gefäßwiderstandes um immerhin 35 % und einer Abnahme der GFR um 20 %. Zusätzlich kommt es zu einem Abfall des Blutdrucks, weil die Plasma-Renin-Aktivität akut und chronisch abnimmt. Bereits nach Infusion von 2 l einer 0,9 % NaCl-Lösung steigt die Plasma-Chlorid-Konzentration vorhersagbar auf 108 mmol/l an, Probanden benötigen ca. 2 Tage zur Normalisierung ihres Flüssigkeitshaushaltes, weil das Renin-Aldosteron-System für 2 Tage auf ca. 60 % supprimiert wird. Somit ist die Hyperchlorämie einer Lösung zu vermeiden.
Kalzium sollte nicht fehlen
Zusätzlich zur Bedeutung von Kalzium für die Erregbarkeit von Neuronen und der elektromechanischen Kopplung von Muskelzellen sollte, wegen der Beteiligung von Kalzium an der Blutgerinnung, die normale Plasma-Konzentration von 2,5 mmol/l in etwa eingehalten werden. Fast die Hälfte dieser Konzentration liegt gebunden an Protein vor, vornehmlich Albumin. Für die Gerinnung entscheidend ist die Konzentration des ionisierten (freien) Ca2+ mit 1,25 mmol/l. Wegen der pH-Abhängigkeit der Proteinbindung nimmt die Ca2+-Konzentration im Sinne einer positiven Gerinnungsfunktion bei Azidose zu, bei Alkalose ab. Bei einem größeren Blutverlust dürfte die Ca2+-Konzentration abnehmen. Als schwere Hypokalzämie, 10 % der Trauma-Patienten zeigen diese, gilt eine therapiebedürftige Ca2+-Konzentration unter 0,9 mmol/l. Für Laktat wird eine Ca2+-Bindung, also Verminderung des freien Kalziums, beschrieben: Bei einer Laktat-Konzentration von 10 mmol/l wird das ionisierte Kalzium von normal 1,25 auf 0,75 mmol/l reduziert, also eine therapiebedürftige Hypokalzämie. Somit ist die Gabe Laktat-haltiger Infusionslösungen (Ringer-Laktat) bei akuter Blutung zu vermeiden, weil eine Hypokalzämie erzeugt oder verstärkt wird. Eine optimale Infusionslösung sollte daher die physiologische Ca2+-Konzentration von mindestens 1,25 mmol/l aufweisen, höhere Werte bis 2,5 mmol/l sichern auch den physiologischen Pool des Albumin-gebundenen Kalziums.
Iso-onkotischer Volumenersatz
Prinzipiell können als Kolloide zur Erzeugung eines physiologischen kolloidosmotischen (onkotischen) Druckes natürliche (Human-Albumin) und künstliche Kolloide (Dextran, Hydroxyethylstärke oder Gelatine) zum Einsatz kommen.
Für Human-Albumin kann derzeit keine Empfehlung als Volumenersatzmittel ausgesprochen werden, da keine evidenz-basierten Vorteile von Albumin gegenüber den kostengünstigeren künstlichen Kolloiden bestehen, die Albumin, limitiert durch den hohen Preis, als Volumenersatzmittel überflüssig machen könnten. Dextran-Lösungen kommen in Europa, abgesehen von den skandinavischen Ländern, kaum noch zum Einsatz. Dies ist vor allem auf die hohe allergene Potenz zurückzuführen.
Bei den HES-Präparaten hat sich die iso-onkotische 6 %ige Lösung mit einem MW von 130 kD (Substitutionsgrad 0,4) gegenüber Präparaten mit höherem MW durchgesetzt. Im Idealfalle gelingt es dem Hersteller, eine weitgehend balancierte, isotone Lösung mit physiologischem Kalzium anzubieten.
Es ist nicht zu übersehen, dass zumindest 6 % HES 200/0,62 im Vergleich mit 3 % Gelatine 30 kD bei Patienten mit schwerer Sepsis und septischem Schock die Nierenfunktion negativ beeinflusst. Die in der aktuellen VISEP-Studie an Sepsis-Patienten erhobenen Befunde zur Nierenschädigung durch 10 % HES (200/0,5) [Brunkhorst et al. 2008] sind deshalb nicht verwertbar, weil ein hyperonkotisches, höhermolekulares HES in hyperchlorämischer Lösung über mehrere Tage erheblich überdosiert appliziert wurde [Zander et al. 2007]. Trotzdem sind dies klinisch relevante Befunde, die weiterer Aufmerksamkeit bedürfen, und in entsprechenden Studien mit 6 % HES 130/0,4 in balancierter Lösung zu überprüfen sind.
Das heute gebräuchlichste Gelatine-Präparat ist eine 4 %ige modifizierte flüssige Gelatine-Lösung (MW 30 kD). Liegt sie in einer NaCl-Basislösung vor, ist sie eindeutig hypoton. Ein neueres Gelatine-Präparat in nahezu balancierter Lösung ist leider ebenfalls deutlich hypoton. Es wäre daher wünschenswert, ein Gelatine-Präparat in isotoner, balancierter Lösung zu erhalten.
Hyperonkotische Lösungen, zum Beispiel 10 % HES (MW 130/0,4) mit einer initialen Volumenwirkung von etwa 150 %, sind in der Notfallmedizin als einmalige Gabe zu empfehlen. Die hyperonkotische Lösung ist erforderlich, um bei akutem (nicht chronischem), vital bedrohlichem Volumenmangel die schnellstmögliche Wiederauffüllung des IVFV unter Einbeziehung von Flüssigkeitsreserven des Interstitiums zu erzielen. Voraussetzung ist ein entsprechend vorhandenes interstitielles bzw. auch intrazelluläres Flüssigkeitsvolumen. Der Vorteil dieser Akut-Therapie der Hypovolämie besteht darin, dass die schnelle physiologische Volumenregulation unterstützt wird, also Flüssigkeits-Verschiebung von extra- nach intravasal mit - abgesehen vom Albumin - physiologisch zusammengesetzter Flüssigkeit einschließlich HCO3. Im Gegensatz zur physiologischen Reaktion mit Senkung des KOD sorgt eine hyperonkotische Infusionslösung hingegen dafür, dass diese Volumenverschiebung unter Aufrechterhaltung des KOD unterstützt wird. Eine Anwendung über mehrere Tage [Brunkhorst et al. 2008] ist logischerweise kontraindiziert [Zander et al. 2007]. Beim Einsatz dieser hyperonkotischen Lösungen sind Präparate in balancierter Lösung einer NaCl-basierten Lösung natürlich vorzuziehen.
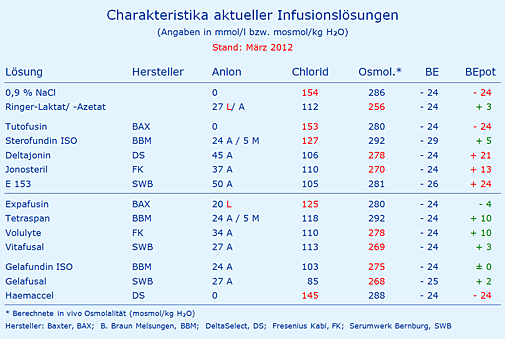
Vergleich aktueller Infusionslösungen
Die derzeit (März 2012) im Markt befindlichen Infusionslösungen sind in der Tabelle Charakteristika aktueller Infusionslösungen aufgeführt, einschließlich obsoleter Lösungen wie 0,9 % NaCl und Ringer-Laktat bzw. -Azetat. Unter klinischen Gesichtspunkten sollte die Auswahl der optimalen Variante in der Reihenfolge BEpot, Osmolalität und Chlorid-Konzentration erfolgen. Einige Lösungen enthalten kein Ca2+ (0,9 % NaCl, Volulyte, Gelafundin), was ebenso berücksichtigt werden sollte.
Klinisches Fazit
Eine optimale balancierte Infusionslösung ist iso-ton mit einem physiologischen Elektrolytmuster von Natrium, Kalium, Kalzium und Chlorid (iso-ionisch), einem physiologischen Säure-Basen-Status mit metabolisierbaren Anionen als Bikarbonatersatz (iso-hydrisch) sowie gegebenenfalls iso-onkotisch. Die Infusion dieser Lösung kann – außer beim Volumen – keine iatrogenen Störungen des Elektrolythaushaltes verursachen, insbesondere keine Hyperchlorämie mit renaler Vasokonstriktion und Abnahme der Diurese. Hat die Lösung einen BEpot von 0 ± 10 mmol/l, dann kann sie nach Infusion plus Metabolisierung der Anionen keinen Einfluss auf den Säure-Basen-Status des Patienten ausüben, also weder in Richtung Azidose noch Alkalose.
Literatur
Brunkhorst FM, Engel C, Bloos F et al.
Intensive insulin therapy and pentastarch resuscitation in severe sepsis
N Engl J Med 2008; 358: 125 - 139
Lönnqvist PA
Inappropriate perioperative fluid management in children: time for a solution?!
Pediatric Anesthesia 2007; 17: 203 - 205
Sümpelmann R, Hollnberger H, Schmidt J, Strauss J, Zander R
Inappropriate perioperative fluid management in children: time for an isotonic solution?!
Pediatric Anesthesia 2008; 18: 191
Zander R
Physiologie und Klinik des extrazellulären Bikarbonat-Pools: Plädoyer für einen bewußten Umgang mit HCO3-
Infusionsther Transfusionsmed 1993; 20: 217 - 235
Zander R, Boldt J, Engelmann L, Mertzlufft F, Sirtl C, Stuttmann R
Studienprotokoll der VISEP-Studie - Eine kritische Stellungnahme
Anaesthesist 2007; 56: 71 - 77
