
Intrakranieller Druck und Osmolalität von Infusionslösungen
Osmolarität (mosmol/l) und Osmolalität (mosmol/kgH2O) einer Infusionslösung
Die osmotische Wirkung einer Infusionslösung wird mit der Osmolarität bzw. Osmolalität beschrieben, leider werden beide Begriffe in der Literatur verwirrend oder falsch verwendet.
Die theoretische Osmolarität kann aus der Addition aller osmotisch wirksamen Substanzen gemäß analytischer Zusammensetzung bezogen auf 1 Liter der Lösung erhalten werden. Hieraus kann mit den osmotischen Koeffizienten und dem Wassergehalt (falls von 100 % abweichend) die reale Osmolalität ermittelt werden, aber jetzt bezogen auf 1 Kilogramm des Lösungsmittels Wasser. Die reale Osmolalität kann auch über die Erniedrigung des Gefrierpunktes (Gefrierpunktsdepression) gemessen werden.
Diese physiologische, reale Osmolalität des Plasmas beträgt 288 mosmol/kgH2O mit einer mittleren Streuung (SD) von 1,8 %; dabei handelt es sich um einen gewichteten Normalwert für 181 Probanden [2, 3, 6]:
Plasma-Osmolalität = 288 ± 5 mosmol/kgH2O
Damit ist zufällig die reale, physiologisch wirksame Osmolalität praktisch identisch mit der theoretischen Osmolarität (291 mosmol/l), die man aus der analytischen Zusammensetzung berechnen kann. Die 0,9 % NaCl-Lösung mit 308 mosmol/l (154 mosmol/l Natrium und 154 mosmol/l Chlorid) weist, umgerechnet mit einem osmotischen Koeffizienten von 0,926 (nur 93 % des NaCl sind osmotisch wirksam) bei einem Wassergehalt von 99,7 % eine Osmolalität von 286 mosmol/kgH2O auf.
Isotonie
Eine physiologisch zusammengesetzte Infusionslösung ist dann isoton, wenn sie die gleiche reale Osmolalität wie das Plasma (288 mosmol/kgH2O) besitzt oder - ersatzweise - die gleiche theoretische Osmolarität einer physiologischen (isotonen) NaCl-Lösung von 308 mosmol/l.
Hat eine wässrige Lösung eine Osmolarität von 308 mosmol/l und enthält als Bikarbonat-Ersatz 24 mmol/l Laktat oder Azetat, dann ändert dies an der Osmolarität nichts, weil der intrazelluläre Metabolismus von Laktat oder Azetat eine äquimolare Freisetzung von 24 mmol/l Bikarbonat verursacht. Diese Lösung bleibt also eindeutig isoton.
Enthält eine Lösung als Bikarbonat-Ersatz hingegen z. B. 5 mmol/l Malat, dann wird die Osmolarität nach dem Metabolismus von Malat um 5 mosmol/l erhöht, weil pro mol Malat zwei mol Bikarbonat freigesetzt werden.
Die formal isotone Glukose-Lösung 5 % mit theoretisch nur 278 mosmol/l ist aus zwei Gründen vollkommen anders zu beurteilen: Einerseits beträgt ihre reale Osmolalität 290 mosmol/kgH2O (Wassergehalt 97 % und osmotischer Koeffizient 1,0133), sie ist also „in vitro“ eindeutig isoton. Da aber andererseits die Glukose nach Infusion dieser Lösung mehr oder weniger schnell in den Intrazellularraum überführt wird, bleibt nur freies Wasser zurück, die „in vivo“ Osmolalität beträgt damit formal 0 mosmol/kgH2O. Mit jeder Glukose-Lösung wird also nur freies Wasser infundiert.
Hypotone Infusionslösungen und intrakranieller Druck (ICP)
Da alle Körperflüssigkeiten des Organismus den gleichen osmotischen Druck wie das Plasma besitzen, charakterisiert durch den Wert der Osmolalität, kann die Infusion einer hypertonen Lösung zu einer Wasserverschiebung aus dem Intra- in den Extrazellularraum führen, umgekehrt eine hypotone Lösung zu einer Wasserverschiebung in den Intrazellularraum. Dieser zweite Fall wird zunehmend kritisch betrachtet, weil viele der in täglicher klinischer Praxis eingesetzten Infusionslösungen hypoton sind. Dazu zählen vor allem Ringer-Laktat bzw. -Azetat mit 276 mosmol/l (anstatt 308) bzw. 256 mosmol/kgH2O (anstatt 288), die zu einer Wasseraufnahme der Organe führen können, ohne dass dies besondere Folgen hätte. Als kritische Ausnahme aber ist das Gehirn (ZNS) anzusehen.
Der in seiner Form nicht veränderbare Schädel beinhaltet drei inkompressible Flüssigkeitsräume, von denen nur zwei, nämlich Blut und Liquor, partiell nach außen verschoben werden können: 1350 ml (g) Gehirn, 125 ml Blut, 145 ml Liquor. Jede Volumen-Änderung eines der drei Kompartimente muss mit einer identischen Änderung eines anderen Raumes beantwortet werden (Hirnödem, intrazerebrale Blutung, subdurales Hämatom, Tumor etc.).
Die Compliance des ZNS beschreibt die Änderung des Blut- bzw. Liquor-Volumens bei Änderung des intrakraniellen Druckes (ICP), ausgedrückt in ml/mmHg. Sie wird als Kehrwert gemessen, Elastance (mmHg/ml) genannt, indem zum Beispiel 1 ml 0,9 % NaCl in die Schädelhöhle appliziert und der resultierende Anstieg des ICP gemessen wird. Damit wird klar, dass jede noch so kleine Volumenzunahme des ZNS zu einem Anstieg des ICP führen muss, bedingt durch die Verschiebung von Liquor oder Blut aus dem Schädel hinaus, was letztendlich zu einer Abnahme der Hirndurchblutung führt.
Mit zunehmendem ICP nimmt die Compliance deutlich ab, weil die Volumenverschiebungen von Blut bzw. Liquor schnell limitiert sind. Der Normalwert der Compliance des ZNS beträgt ca. 0,5 ml/mmHg [8], das heißt, dass jede Volumenzunahme des ZNS um nur 1 ml mit einem Anstieg des ICP von 2 mmHg beantwortet werden muss. Dieser Anstieg des ICP nimmt mit weiterer Volumenzunahme überproportional zu, weil die Compliance des ZNS abnimmt. Ein Anstieg des ICP auf 30 mmHg für länger als einen Tag wird kaum ohne bleibende Schäden überlebt [8]. Am Beispiel von Ringer-Laktat (RL) soll die Problematik verdeutlich werden.
Es ist lange bekannt, dass größere Volumina von RL einen vorübergehenden Anstieg des ICP verursachen [11], allerdings nicht so stark wie nach Infusion größerer Volumina 5 %iger Glukose-Lösung [1]. Tatsache ist auch, dass die Plasma-Osmolalität durch Infusion von RL gesenkt werden kann [7, 10], auch an Versuchspersonen demonstriert, allerdings nach Infusion von 3,75 l RL innerhalb von 1 h [13].
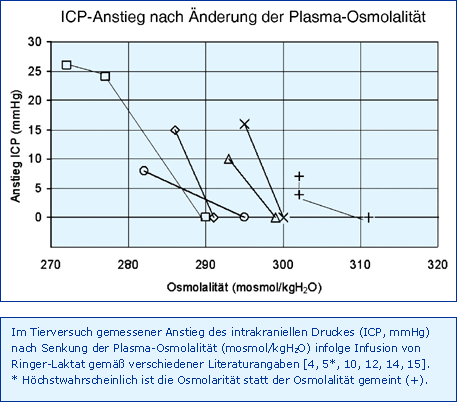
Eine Vorhersage, welche Senkung der Plasma-Osmolalität welchen Anstieg des ICP bewirkt, soll wie folgt versucht werden: Die Abnahme der Osmolalität von 288 auf 287 mosmol/kgH2O (- 0,35 %) sollte eine Zunahme des ZNS von 1350 auf 1355 ml (+ 0,35 %) in Folge des osmotischen Wassereinstroms bewirken, also eine Zunahme um 5 ml, die ihrerseits eine Steigerung des ICP um 10 mmHg bewirken sollte (Compliance 0,5 ml/mmHg). Dieser Wert fällt deutlich kleiner aus als der in der Literatur genannte Schätzwert von 19 mmHg pro 1 mosmol/l [9]. Trotzdem scheint diese grobe Abschätzung realistisch zu sein, wie mit den Daten der Abb. ICP-Anstieg nach Änderung der Plasma-Osmolalität demonstriert werden soll:
Der nach Senkung der Plasma-Osmolalität im Tierversuch gemessene Anstieg des ICP [4, 5, 10, 12, 14, 15] beträgt (mit großer Streuung) im Mittel 1,5 mmHg pro 1 mosmol/kgH2O Senkung der Plasma-Osmolalität. Auch die Messung der Änderung des Wassergehaltes des Gehirns nach Senkung der Osmolalität um 13 mosmol/l und Anstieg des ICP um 8,1 mmHg [15] führt zu einem ähnlichen Ergebnis: 0,5 % Wassergehaltsänderung (6,75 ml) sollten zu einem ICP-Anstieg von 13,5 mmHg führen (Compliance 0,5 ml/mmHg), ein Wert, der mit dem gemessenen Wert von 8,1 mmHg durchaus zu vergleichen ist.
Fazit
Die Infusion größerer Volumina hypotoner Lösungen ist zu vermeiden, insbesondere dann, wenn intrakraniell raumfordernde Prozesse (Hirnödem, intrazerebrale Blutung, subdurales Hämatom, Tumor etc.) vorliegen. Isotonen Lösungen ist daher in jedem Fall der Vorzug zu geben. Dies gilt vor allem für Säuglinge und Kleinkinder, weil die noch nicht vollständig verschlossene Schädeldecke ein zusätzliches Risiko beinhaltet.
Literatur
- Bakay L, Crawford JD, White JC: The effects of intravenous fluids on cerebrospinal fluid pressure. Surg Gynecol Obstet 1954; 99: 48 - 52
- Glasser L, Sternglanz, PD, Combie J, Robinson A: Serum osmolality and its applicability to drug overdose. Am J Clin Path 1973; 60: 695 - 699
- Hendry EB: Osmolarity of human serum and of chemical solutions of biological importance. Clin Chem 1961; 7: 156 - 164
- Hyodo A. Heros RC, Tu YK, Ogilvy C, Graichen R, Iagree K, Korosue K: Acute effects of isovolemic hemodilution with cristalloids in a canine model of focal cerebral ischemia. Stroke 1989; 20: 534 - 540
- Kaieda R, Todd MM, Cook LN, Warner DS: Acute effects of changing plasma osmolality and colloid oncotic pressure on the formation of brain edema after cryogenic injury. Neurosurg 1989; 24: 671 - 678
- Olmstead EG, Roth DA: The relationship of serum sodium to total serum osmolarity: A method of distinguishing hyponatremic states. Am J Med. Sci 1957; 233: 392 - 399
- Reid F, Lobo DN, Williams RN, Rowlands BJ, Allison SP: (Ab)normal saline and physiological Hartmann’s solution: A randomized double-blind crossover study. Clin Sci 2003; 104: 17 - 24
- Schalk HV, Fuchs G: Erhöhter intrakranieller Druck. In: Komplikationen in der Anästhesie (3. Aufl.) (List WF, Osswald PM Hrsg.) Springer, Berlin 1997
- Schell RM, Applegate RL, Cole DJ: Salt, starch, and water on the brain. J Neurosurg Anesth 1996; 8: 179 - 182
- Shackford SR, Zhuang J, Schmoker J: Intravenous fluid tonicity: Effect in intracranial pressure, cerebral blood flow, and cerebral oxygen delivery in focal brain injury. J Neurosurg 1992; 76: 91 - 98
- Tommasino C, Moore S, Todd MM: Cerebral effects of isovolemic hemodilution with crystalloid or colloid solutions. Crit Care Med 1988; 16: 862 - 868
- Walsh JC, Zhuang J, Shackford SR: A comparison of hypertonic to isotonic fluid in the resuscitation of brain injury and hemorrhagic shock. J Surg Res 1991; 50: 284 - 292
- Williams EL, Hildebrand KL, McCormick SA, Bedel MJ: The effect of intravenous lactated Ringer’s solution versus 0.9 % sodium chloride solution on serum osmolality in human volunteers. Anesth Analg 1999; 88: 999 - 1003
- Zornow MH, Scheller MS, Shackford SR: Effect of a hypertonic lactated Ringer’s solution on intracranial pressure and cerebral water content in an model of traumatic brain injury. J Trauma 1989; 29: 484 - 489
- Zornow MH, Todd MM, Moore SS: The acute cerebral effects of changes in plasma osmolality and oncotic pressure. Anesthesiology 1987; 67: 936 - 941
