
Volumen- und Hämotherapie beim Schwerverletzten


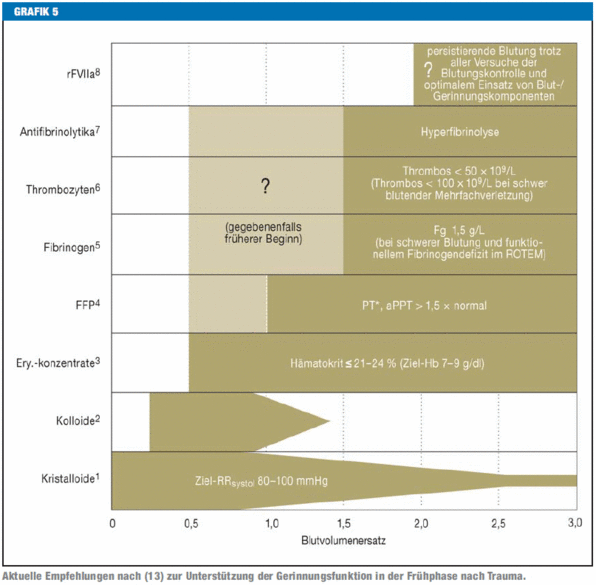
Zu dieser Arbeit im Deutschen Ärzteblatt 2011; 108: 827-835 (die vollständige Version finden Sie hier) wurde von R. Zander ein Leserbrief eingereicht, der aber vom Deutschen Ärzteblatt wegen Überschreitens der Maximallänge von 250 Wörtern nicht angenommen wurde. Dankenswerterweise haben die Autoren eine Antwort zur Verfügung gestellt, die hier zusammen mit dem Leserbrief wiedergegeben wird. Die Diskussion bezieht sich vor allem auf die Graphik Nr. 5, in der die Reihenfolge (1-8) der Therapiemaßnahmen zur Unterstützung der Gerinnungsfunktion beschrieben wird.
Kommentar R. Zander
Soweit es die im Untertitel genannten Themen Inzidenz und Risikostratifizierung betrifft, wird hier eine ausgezeichnete Übersicht publiziert, aber nicht die aktuellen Therapieansätze betreffend. Therapieansätze müssen sich – wie so oft in der Medizin – auf die Prophylaxe und damit Verhinderung von Störungen beziehen, nicht auf die Diagnostik und Therapie von Symptomen.
Die Autoren beschreiben die Gerinnungsstörung, nicht aber das Kernproblem der so genannten lethalen Trias, nämlich die Koagulopathie als direkte Folge von Hypothermie und Azidose. Mit Ausnahme der Gewebeschädigung/Inflammation lassen sich die anderen besprochenen Initiatoren anstandslos in diese Trias einordnen: Hypoperfusion und Hämodilution verursachen eine Lakt- bzw. eine Dilutions-Azidose.
Die Fakten: Bei einer Temperatur von 32 statt 37 °C nimmt die Gerinnungsaktivität auf 50 % ab, ebenso bei einer Azidose mit einem pH von 7,2 entsprechend einem Basen-Defizit (negativer BE) von 12,5 mmol/l. Dieser Punkt ist deshalb entscheidend, weil die Wirkung der Azidose für ca. 15 Stunden irreversibel, also Therapie-resistent ist.
Die Diagnostik: Die von den Autoren propagierte, patientennahe POC-Diagnostik (point of care) hat hier gravierende Mängel: Derzeit arbeiten fast alle Geräte und Verfahren bei 37 °C mit der Folge, dass die temperaturbedingte Gerinnungsstörung nicht erfasst wird. Auch die Azidose wird nicht erfasst, weil praktisch alle diagnostischen Schritte den ursprünglichen pH-Wert des Patientenblutes mehr oder weniger korrigieren. Fazit: Die Diagnostik des hypothermen, azidotischen Patienten versagt, dies gilt für die POC- ebenso wie für die Labor-Diagnostik.
Die Therapie: Zur Graphik 5 (Aktuelle Empfehlungen zur Unterstützung der Gerinnungsfunktion in der Frühphase nach Trauma) werden Alternativen aufgezeigt.
Im ersten Schritt werden nicht spezifizierte Kristalloide zur Therapie der Hypoperfusion empfohlen. Diese sind als Volumenersatz (!) insuffizient, weil zig-fach belegt wurde, dass davon nur 20 % intravasal verbleiben, während 80 % in den Extravasal- bzw. Extrazellularraum verschwinden. Die Hypoperfusion wird so nicht verhindert und wenn sie nicht balanciert sind, erzeugen sie eine Dilutions-Azidose.
Erst im zweiten Schritt folgen dann die sinnvollen Kolloide, ohne dass die Art des Kolloids näher spezifiziert wird.
Wenn die Autoren mit retrospektiven Daten des extrem guten Traumaregisters der DGU belegen, dass die Gerinnungsstörung mit zunehmender präklinischer Volumengabe zunimmt, dann ist dies ein „gelungener“ Beleg für den Einsatz nicht balancierter Infusionslösungen. Balancierte, also physiologisch zusammengesetzte Lösungen hingegen sind nicht nur iso-natriämisch, -kaliämisch, -chlorämisch und isoton, sondern enthalten auch das für die Gerinnung wichtige Kalzium. Entscheidend aber ist in diesem Zusammenhang ihre Eigenschaft der Isohydrie, das heißt mit einem potentiellen BE (BEpot) von angenähert 0 mmol/l versehen, können sie keinen Einfluss auf den Säure-Basen-Status des Patienten ausüben, sie verhindern die für nicht balancierte Lösungen obligatorische Verdünnungs- (Dilutions-) Azidose.
An dritter Stelle werden dann Erythrozyten-Konzentrate (EKs) empfohlen, ein fataler Irrtum. Bereits frische EKs haben ein Basen-Defizit (BD) von 20 und nach max. 42 Tagen Lagerungszeit ein BD von 50 mmol/l. Sie verstärken die Azidose und damit die Gerinnungsstörung und sollten - möglichst frisch - erst als ultima ratio bei nachgewiesenem Hb-Mangel eingesetzt werden. Da sie nach 42 Tagen Lagerung auch 30 mmol/l Laktat enthalten, das nachweislich Kalzium bindet, sind sie schon deshalb kontraindiziert.
Die Alternative für die zweite Stelle nach den Kolloiden kann nur Plasma sein, nämlich als Volumenersatz, zur Gerinnungs- und zur Azidose-Prophylaxe.
- Plasma stellt einen optimalen Volumenersatz dar. In den Richtlinien der BÄK wird Plasma als primärer Volumenersatz ausdrücklich abgelehnt, wenn es um den sekundären Einsatz als Gerinnungstherapeutikum geht, das ist in sich logisch. Wenn hingegen Eigenplasma in den gleichen Richtlinien als optimaler Volumenersatz bezeichnet wird, dann zeigt dies nur die Unsicherheit der Verfasser dieser Richtlinien.
Die Autoren selbst (Lit. 7) haben überzeugend dargelegt, dass man mit der frühen Gabe von Plasma statt EKs die Mortalität dramatisch senken kann. - Es gibt keinen Sinn, die im Plasma vorhandenen Gerinnungsfaktoren nicht über die frühe Gabe von Plasma zu nutzen: Warum sollen die verbliebenen Gerinnungs-Faktoren erst mit dem kolloidalen Volumenersatz verdünnt werden um sie anschließend mit Faktoren-Konzentraten wieder zu ersetzen? Auch hier fürchten die Autoren bei später Gabe von FFP eine „Volumenüberladung“, auch das ist in sich logisch, aber vermeidbar. Im Jahre 2010 wurden in Deutschland nach Angaben des Paul Ehrlich-Instituts 1,2 Mio Einheiten FFP von Ärzten verordnet und 2,9 Mio Einheiten Plasma zur Produktion von Faktoren-Konzentraten an die Industrie weitergereicht. Das könnte doch leicht geändert werden.
- Plasma ist im Gegensatz zu den EKs eine stark alkalisierende Lösung, weil das alkalisierende Zitrat zu etwa 95 % im Plasma verbleibt. Plasma verhindert daher prophylaktisch jede Azidose. Auch unter diesem Gesichtspunkt ist die Trennung von Erythrozyten und Plasma heute zu hinterfragen.
Das Argument der Autoren gegen Plasma, nämlich zu lange Vorbereitung für den Einsatz wegen des Auftauens, kann sehr einfach entkräftet werden: Wenn endlich das bereits praktizierte lyophilisierte Plasma zum Einsatz kommt, am besten als Lyo-Eigen-Plasma, dann ist auch dieses Argument hinfällig.
Ob der Einsatz von Fibrinogen noch notwendig ist (Platz 5 im Schema), bleibt abzuwarten, wenn eines Tages das Plasma an die zweite Stelle gerückt ist.
Auch die TKs (Platz 6 des Schemas) sind azidotische Präparate, am Tag 0 haben sie ein BD von 12 und am Tag 5 ein solches von 18 mmol/l, daher sind sie nur mit Vorsicht einzusetzen.
Inwieweit schließlich die Antifribrinolytika und der rekombinante Faktor VIIa (Platz 7 und 8 im Schema) dann noch notwendig sind, bleibt fraglich. Am Beispiel von rFVIIa kann die Problematik gut beschrieben werden: Die letzte Empfehlung des Herstellers lautete: Einsatz als ultima ratio bei persistierender Blutung nach Gabe des 7. EK. Dies hat keine Aussicht auf Erfolg, nachdem die Azidose durch die Gabe von 7 EKs verstärkt wurde: 7 EKs = ca. 2,5 Liter enthalten schon nach 3 Wochen Lagerung ca. 100 mmol Säure, diejenige Menge, die die normale Niere in 2 Tagen zu eliminieren hat.
Fazit
Das Therapieschema für die akute Blutung muss unter dem Slogan „Azidose verhindern“ stehen und folglich lauten: Zuerst balancierte Kolloide, dann Lyo-Plasma, dann ohne Azidose Gerinnungspräparate, zum Schluss, wenn überhaupt, möglichst frische EKs und TKs.
Antwort: Für die Autoren Prof. Dr. med. Marc Maegele
Die Autoren bedanken sich für das Interesse an der vorliegenden Arbeit und für die zum Thema formulierte Einschätzung und Stellungnahme. Es wird zu Recht bemerkt, dass sich die Therapieansätze in der Medizin nicht auf die Therapie von Symptomen sondern und vor allem auf die Prophylaxe und Verhinderung von Störungen beziehen müssen. Auf die aktuell diskutierten Initiatoren und Trigger der akuten trauma-assoziierten Gerinnungsstörung wird zu Beginn der Übersichtsarbeit im Detail eingegangen und hier insbesondere die Kombination aus Koagulopathie, Azidose und Hypothermie als sogenannte „lethale Triade“ als entscheidendes Moment für die Störung betont. Der Einfluss von Temperatur und pH auf die Aktivität von Gerinnungsfaktoren wurde von Meng und Kollegen, wie richtig bemerkt, bereits vor Jahren eindrucksvoll demonstriert.
Die patientennahe „point-of-care“-Diagnostik und der darauf basierende Ansatz für ein Faktorenkonzentrat-basiertes Gerinnungsmanagement wird von den Autoren nicht „propagiert“ sondern als ein alternatives Konzept vorgestellt und diskutiert. Die Autoren stimmen überein, dass auch diese Technologien nach wie vor Defizite aufweisen und bestimmte Subtypen der trauma-assoziierten Gerinnungsstörung über diese Verfahren nicht eindeutig detektiert werden und somit auch viskoelastische Testverfahren ebenfalls nicht das wahre und vollständige Gerinnungsprofil zu einem bestimmten Zeitpunkt nach Trauma repräsentieren. Dennoch belegen einige aktuelle Arbeiten, dass viskoelastische Verfahren gegenüber den konventionellen Testverfahren gewisse Vorteile bei der Früherkennung der akuten trauma-assoziierten Gerinnungsstörung aufweisen und somit zur frühen Risikostratifizierung von blutenden Traumapatienten beitragen können. Diese Ergebnisse müssen jedoch noch prospektiv validiert werden.
Bei den vorgestellten Empfehlungen zur Unterstützung der Gerinnungsfunktion bei blutenden Patienten in der Frühphase nach Trauma handelt es sich um eine Synopse der jüngst überarbeiteten Empfehlungen einer europäischen Konsensusgruppe. Diese sehen zur Initialtherapie beim blutenden Traumapatienten sowohl Kristalloide (Evidenzgrad 1B) als auch alternativ hypertone Lösungen vor (Evidenzgrad 2B). Letztere innerhalb der empfohlenen Limitierungen für jede Einzelsubstanz bei hämodynamischer Instabilität ohne dass die Art des Kolloids näher spezifiziert wird. In diesem Zusammenhang ist jedoch zu berücksichtigen, dass im Rahmen einer multivariaten Analyse von Daten aus dem TraumaRegister® der Deutschen Gesellschaft für Unfallchirurgie ein Kolloid-Kristalloid-Verhältnis ? 1:2 im Rahmen der frühen Volumenzufuhr beim blutenden Traumapatienten als ein unabhängiger Risikofaktor für das Auftreten einer akuten trauma-assoziierten Gerinnungsstörung identifiziert wurde.
In einem weiteren Punkt wird die kritische Frage nach dem Alter der applizierten Erythrozytenkonzentrate adressiert. Richtig wird hier bemerkt, dass mit höherer Lagerungsdauer das Besendefizit (BD) ansteigt und hier insbesondere „ältere“ Produkte das Risiko der Azidose und damit der Gerinnungsstörung verstärken. Nach dieser Einschätzung sollten Erythrozytenkonzentrate erst als „ultima ratio“ bei nachgewiesenem Hb-Mangel eingesetzt werden. Neben den immunologischen Konsequenzen der Gabe einer jeden Einzelkonserve sollte, in Ergänzung zu den genannten Punkten, die Indikation zur Gabe von Erythrozytenkonzentraten per se kritisch gestellt werden, hier stimmen die Autoren ohne Einschränkung zu, nur liegt bei den meisten klinisch blutenden Traumapatienten, mögen sie nach innen oder außen bluten, bei hämodynamischer Instabilität bereits ein relevanter Hb-Mangel vor, der die Gabe von Erythrozytenkonzentraten erforderlich macht. Auf die Wichtigkeit der Überwachung des ionisierten Ca2+-Spiegels im Rahmen von Massentransfusionen mit ggf. Substitution bei erniedrigten Spiegeln und/oder EKG-Veränderungen gehen die aktuellen Empfehlungen der Konsensusgruppe ein.
Die frühe Gabe von Frischplasma bei Patienten mit massiver Blutung, wie gefordert, wird in den aktuellen Empfehlungen der europäischen Konsensusgruppe mit einem Evidenzgrad 1C in der initialen Dosierung von 10-15 ml/kg empfohlen; allerdings erst in der zeitlichen Sequenz nach der Gabe von Volumenersatzmitteln und Erythrozytenkonzentraten. Gerade diese zeitliche Abfolge wird momentan intensiv diskutiert. Eine Reihe von Untersuchungen, unter anderem von den Autoren selber vorgelegt, unterstreichen inzwischen eindrucksvoll den möglichen Überlebensvorteil zu Gunsten der frühen Gabe von Frischplasma in einem balancierten Verhältnis zu Erythrozyten- und Thrombozytenkonzentraten bei Hochrisikopatienten. Die Trennung von Erythrozyten und Plasma ist im Rahmen der balancierten Therapie aufgehoben und hier wird der alkalisierende Effekt von Plasma offensichtlich therapeutisch nutzbar gemacht. Die Autoren haben die Empfehlungen der Konsensusgruppe vor diesem Hintergrund modifiziert und diskutieren in ihrer Übersichtsarbeit die Gabe von Frischplasma bereits in der Akutphase, zumindest bei Hochrisikopatienten für eine anhaltende Blutungssituation mit drohender Massentransfusion. Eine ähnliche Diskussion wird um den frühen Einsatz von Thrombozytenkonzentraten geführt, so dass momentan erstmalig im Sinne eines prospektiven und multizentrischen Studienansatzes der optimale Zeitpunkt und das optimale Verhältnis in der balancierten Gabe von Blutprodukten bei blutenden Traumapatienten untersucht wird (PROPPR-Studie). Zu bedenken ist in diesem Zusammenhang jedoch, dass es selbst unter der frühen und balancierten Gabe von Frischplasmen einige Zeit dauern kann, bis sich die Globalparameter der Blutgerinnung „normalisiert“ haben; diese kann selbst bei aggressiver Therapie bis zu 14 Stunden dauern, wie von Gonzales und Kollegen gezeigt wurde.
Obgleich, wie bemerkt, der Auftauprozess beim Einsatz von lyophilisiertem Plasma entfällt, bleibt doch, wie die Autoren meinen, zu diskutieren, ob nicht der frühe Einsatz von Substrat in Form von Fibrinogen in der Akutphase einen therapeutischen Vorteil bringen könnte. Fibrinogen erreicht vor allen anderen Gerinnungsfaktoren kritische Werte, die substitutionspflichtig erscheinen. Wo kein Substrat mehr verfügbar ist, kann auch nichts gerinnen! Ähnlich dem balancierten Konzept der Blutproduktgabe basiert auch das Faktorenkonzentratkonzept auf den Daten retrospektiver Untersuchungen. Unterschiedliche prospektive Studien sind hier in der Planung oder haben bereits begonnen.
Für den frühen Einsatz von Antifibrinolytika sprechen die Ergebnisse der CRASH-2-Studie und die Einschätzung, dass vermutlich mehr Traumapatienten an einer akuten Hyperfibrinolyse leiden als bislang angenommen; genaue Zahlen fehlen jedoch auch hier. Für den Einsatz von rFVIIa sollte es nach wie vor eine spezielle Subpopulation an blutenden Traumapatienten geben, die bislang noch nicht eindeutig identifiziert ist. Für den Einsatz der Substanz existieren Empfehlungen zur Gabe, u.a. pH > 7.2.
Weiterführende Artikel finden sich in Physioklin unter Themen-Übersicht: Base-Excess und Gerinnung, Erythrozyten-Konzentrate, Gerinnungsdiagnostik, Größere Blutung und Azidose, Kristalloide versus Kolloide, Laktat-Clearance, Massivblutung, Volumentherapie.
