
Therapie
Für die Therapie entscheidend sind die drei folgenden Fragen: An welcher Größe orientiert sich die Therapie, nach welchem Zeitmuster wird therapiert und wie weit soll die Therapie geführt werden?
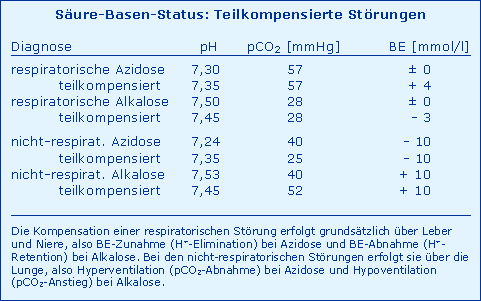
Die Betrachtung der in der Tab. Teilkompensierte Störungen zusammengestellten Beispiele teilkompensierter Störungen des Säure-Basen-Haushaltes zeigt, dass sich die Therapie von Störungen prinzipiell an den beiden Werten pCO2 und BE orientieren muss. Da es unter klinischen Bedingungen praktisch niemals vollkompensierte Störungen gibt, sind somit nur die nicht kompensierten von den teilkompensierten Störungen zu unterscheiden, wobei der Regelfall zumindest für die nicht-respiratorischen Störungen die teilkompensierte Störung ist.
Für die Therapie entscheidend ist, dass die primäre Störung erkannt und therapiert wird, also der pCO2 bei den respiratorischen Störungen und der BE bei den nicht-respiratorischen Störungen normalisiert wird.
Die Frage nach dem Zeitmuster einer Therapie kann dadurch beantwortet werden, dass die Änderungen der beschriebenen Größen bei Totalausfall eines der Regelorgane abgeschätzt wird.
Ein plötzlicher Atemstillstand (Apnoe) führt zu einem überproportionalen Anstieg des paCO2 in der ersten Minute von ca. 13 mmHg und nachfolgend von ca. 3 mmHg/min. Für eine Apnoe von 10 min Dauer bedeutet dies einen Anstieg von 40 auf 80 mmHg mit Ausbildung einer Azidose mit einem pH-Wert von 7,20.
Bei einem Totalausfall der Leberfunktion würde im wesentlichen die Milchsäure-Verwertung sistieren, pro Stunde verblieben 40 mmol Milchsäure im Organismus, die im EZR (15 l) und damit im Blut einen BE von etwa - 3 mmol/l verursachen würden. Bei einer verstärkten, z. B. hypoxisch bedingten, Milchsäure-Freisetzung würden sich die Bedingungen natürlich ändern.
Ein Totalausfall der Nierenfunktion (Anurie) müsste zu einem Anstieg fixer H+-Ionen von 40 - 80 mmol pro Tag führen, also einen negativen BE von - 3 bis - 5 mmol/l pro Tag verursachen.
Auch das Zeitmuster für die Entstehung einer intestinalen (nicht-respiratorischen) Alkalose durch Verlust von Mageninhalt kann für das Verständnis hilfreich sein: Um im EZR des Patienten einen BE von + 10 mmol/l zu erzeugen, muss der Patient 15 l Magensaft (pH 2,0) verlieren (s. o.), was sicher einige Stunden beansprucht. Das aus diesen Beispielen abzuleitende Zeitmuster kann daher lauten: Respiratorische Störungen müssen in Minuten, nicht-respiratorische Störungen in Stunden therapiert werden.
Die Frage nach dem Ausmaß der Therapie wird im Folgenden bei der Besprechung der Störungen gesondert beantwortet. Dazu sind die in Tab. Teilkompensierte Störungen aufgeführten Beispiele zusätzlich graphisch in der Abb. Diagnostik im sogenannten Siggaard-Andersen-Nomogramm wiedergegeben.
Respiratorische Störungen
Eine Abweichung der respiratorischen Größe pCO2 vom Normalwert 40 mmHg kennzeichnet die respiratorische Störung, als Azidose oder Alkalose. Die gestörte Lungenfunktion sollte therapeutisch angegangen oder die Beatmung geändert werden, sobald sichergestellt ist, dass die Änderung des pCO2 die primäre Störung charakterisiert. Dies ist nur dann der Fall, wenn ein gesenkter pCO2 mit einer Alkalose und ein erhöhter pCO2 mit einer Azidose gekoppelt sind. Ansonsten, pCO2 ↑ und pH ↑ oder pCO2 ↓ und pH ↓, handelt es sich um kompensatorische Änderungen, die keiner Therapie zugeführt werden dürfen.
Nicht-respiratorische Störungen
Die Therapie der nicht-respiratorischen Störungen orientiert sich allein am BE in Verbindung mit dem pH-Wert des Patienten. Das Zeitmuster und das Ausmaß der Therapie (soll der BE und damit der pH auf Normalwerte therapiert werden?) müssen allerdings besonders betrachtet werden. Dies soll am Beispiel einer Lakt-Azidose erfolgen. Der prinzipielle Unterschied zwischen der Zufuhr von Milchsäure als hypoxische Produktion im Gewebe und Laktat mit einer Infusionslösung wird in der Tab. Rebound-Alkalose mit den beiden möglichen diagnostischen Werten BE (mmol/l) und Laktat-Konzentration (mmol/l) erläutert.

Die Beispiele der Tab. Rebound-Alkalose lassen folgenden generellen Schluss zu: Jede Therapie der Azidose kann nur die H+-Ionen eliminieren, die immer noch vorhandenen Laktat-Ionen aber werden von der Leber unter äquimolarem Verbrauch von H+-Ionen metabolisiert, womit der therapeutische Ansatz quasi verdoppelt wird. Somit wird verständlich, warum Lakt-Azidosen dem behandelnden Arzt so große Probleme bereiten: Jede vollständige Therapie der Azidose im Sinne der pH-Normalisierung führt zwangsläufig zu einer protrahiert auftretenden, metabolischen Alkalose gleichen Ausmaßes, sogenannte rebound alkalinization bzw. alkaline overshoot.
Das Beispiel einer Zufuhr von Ringer-Laktat-Lösung (27 mmol/l Laktat) hingegen macht klar, dass Laktat zu einer entsprechenden, therapeutisch erwünschten Alkalisierung des Organismus führen muss, hier als sinnvolle Kompensation der Dilutions-Azidose.
Vor diesem Hintergrund ist es daher nicht gerechtfertigt, die Azidose bis zu einem pH von 7,40 zu normalisieren, da jede, insbesondere rasche Korrektur eines negativen BE-Wertes zwangsläufig nach Minuten oder Stunden eine Rebound-Alkalose zur Folge haben muss. Das Ausmaß dieser Alkalose hängt dabei vom Wiedereinsetzen des intakten Leberstoffwechsels ab, der ja für die Ausbildung der Lakt-Azidose mitverantwortlich war. Da die intakte Leber maximal 400 mmol Laktat pro Stunde umsetzen kann (s. o.), könnte sich ein vollständig therapierter BE von - 15 mmol/l, entsprechend verbliebener 225 mmol Laktat (15 mmol/l x 15 l), in etwa einer halben Stunde in eine Rebound-Alkalose mit BE + 15 mmol/l umwandeln, der resultierende pH von 7,60 müsste sofort mit einer sehr deutlichen Hypoventilation beantwortet werden.
Es ist daher zu empfehlen, die Lakt-Azidose erst ab einem BE von ca. - 12 mmol/l (pH ohne Kompensation 7,20) zu therapieren und unter laufender Kontrolle des BE auf einen Wert von ca. - 6 mmol/l (pH ohne Kompensation 7,30) zu halten. Besteht die Möglichkeit zur Bestimmung von Laktat im Plasma, so kann die Laktat-Konzentration zur Vorhersage einer drohenden metabolischen Alkalose sehr hilfreich sein.
Als Konsequenz wird in diesem Zusammenhang die angeblich unbedenkliche Verwendung laktathaltiger Infusionslösungen [Seeling, Ahnefeld 1988] kritisiert: Nicht nur dass es keinen Sinn ergibt, während Lakt-Azidose zusätzliches, nicht verwertbares Laktat zuzuführen und damit die später drohende Rebound-Alkalose noch zu verstärken, sondern auch die Diagnostik wird durch extern zugeführtes Laktat (Ringer-Laktat-Lösung) entscheidend gestört.
Therapeutika: Bikarbonat / Tris / Argininhydrochlorid
Zur Therapie nicht-respiratorischer Störungen stehen verschiedene Therapeutika zur Verfügung, die zumeist in konzentrierter Form zum Einsatz kommen. Ihre Dosierung erfolgt mit dem Ziel, den BE des Extrazellularraumes zu therapieren, der über den BE des Blutes diagnostiziert wurde. Zur Ermittlung des EZR und damit der notwendigen Dosierung hat sich eine Faustregel durchgesetzt, die einen effektiven Verteilungsraum für das Therapeutikum von 30 % des Körpergewichts (KG) annimmt, obwohl der EZR beim Erwachsenen nur ca. 20 % des KG ausmacht. Die Dosierung erfolgt daher nach der Formel: Dosierung (mmol) = BE (mmol/l) x 0,3 x KG (kg). Beispiel: Bei einem Patienten mit einem KG von 67 kg und einem BE von - 10 mmol/l ergibt sich daraus eine Dosis von 200 mmol, entsprechend 200 ml einer 1 molaren Lösung (z. B. Natriumhydrogenkarbonat 8,4 % = 84 g/l = 1000 mmol/l).
Bikarbonat
HCO3- ist im Allgemeinen das Mittel der Wahl bei der Therapie der nicht-respiratorischen Azidosen, weil die bei der Pufferung fixer H+-Ionen entstehenden Endprodukte CO2 und H2O leicht über Lunge und Niere eliminiert werden können. Diese scheinbar einfache Aussage muss aber, insbesondere für die Notfallmedizin, wie folgt konkretisiert werden: Nur die nicht-respiratorische Azidose kann und darf mit HCO3- therapiert werden, wenn zusätzlich sichergestellt ist, dass das entstehende CO2 über eine ausreichende Perfusion und Atmung oder Beatmung über die Lunge eliminiert werden kann.
In diesem Sinne lautet die logische Empfehlung der American Heart Association [1986], die sich damit gegen die sogenannte "Blind-Pufferung" ausgesprochen hat. Der Einsatz von HCO3- beim spontan atmenden Patienten muss daher zu einer Stimulierung der Atmung führen, wie folgendes Beispiel zeigen kann: Bei dem o. g. Beispiel einer Gabe von 200 mmol HCO3- zum Ausgleich eines BE von - 10 mmol/l müssen nach Pufferung zusätzlich 4.500 ml CO2 (200 x 22,4) eliminiert werden. Dazu benötigt die Lunge bei Verdoppelung der Ventilation etwa 20 min, bei Steigerung der Ventilation um nur 50 % immerhin etwa 40 min. Bei künstlicher Beatmung des Patienten ist dies natürlich auch zu berücksichtigen. Zusätzlich zu beachten ist die Belastung des Patienten mit Natrium, im o. g. Beispiel immerhin 10 - 15 mmol/l bezogen auf den Verteilungs- oder den Extrazellularraum, die die Niere auszugleichen hätte.
Tris
Tris oder THAM (Tris-hydroxy-amino-methan, Trometamol) ist im Gegensatz zu HCO3- in der Lage, respiratorische und nicht-repiratorische (fixe) H+-Ionen zu puffern. Daher ist es ein bisweilen auch bei respiratorischer Azidose einzusetzendes Therapeutikum. Bei Einsatz zur Therapie einer nicht-respiratorischen Azidose muss logischerweise mit einer Abnahme des pCO2 gerechnet werden, die "gewünschte" Atemdepression als eine für die Therapie wichtige "Nebenwirkung" [Zander 1987].
Ein großer Vorteil von Tris besteht in der Tatsache, dass mit der organischen Base kein Natrium zugeführt wird. Die Gabe von Tris (0,3 - 3 mol/l) erfolgt als Base (pH ca. 9), die Ausscheidung erfolgt schnell als Tris-H+ über die Niere mit deutlicher diuretischer Wirkung.
Argininhydrochlorid
Eine ausgeprägte nicht-respiratorische Alkalose mit BE-Werten über + 10 mmol/l bedarf wegen der zwangsläufig einsetzenden Hypoventilation einer ansäuernden Therapie. Dies kann direkt mit konzentrierter HCl erfolgen, wegen des sehr sauren pH-Wertes derselben muss die Zufuhr über einen Vena cava-Katheter in ein großes Blutvolumen erfolgen. Bei einem BE von + 15 mmol/l wären dies zum vollständigen Ausgleich (67 kg KG) immerhin 300 mmol oder 300 ml einer 1 molaren HCl (pH = 0), oder - unrealistisch - 3.000 ml einer 0,1 molaren HCl (pH = 1). In diesen Fällen wird daher primär eine teilweise Korrektur angestrebt, um zumindest die Hypoventilation zu beheben.
Argininhydrochlorid ist die bereits in der Tab. Aminosäuren aufgeführte Aminosäure Arginin bei pH 7,40 in der Säure-Form, nämlich als Arginin-NH2+. Der physiologische pH ist hierbei der entscheidende Vorteil, der aber dem Nachteil gegenübersteht, dass die Wirkung von Argininhydrochlorid erst nach Metabolisierung durch die Leber erfolgen kann, weil erst dann das erwünschte H+ freigesetzt wird. In vielen Fällen wird man daher eine rasche Korrektur mit HCl und eine protrahierte mit L-Arginin-Hydrochlorid (1 molare Lösung) vornehmen.
Das therapeutische Ziel sollte darin bestehen, den pCO2 nicht über 55 mmHg ansteigen zu lassen (BE ca. + 10 mmol/l), weil dadurch der arterielle pO2 auf ca. 65 mmHg und die arterielle O2-Sättigung auf ca. 92 % fallen würden. Natürlich kann kurzfristig die arterielle Hypoxie durch Erhöhung der FIO2 vermieden werden.
Dialyse: Die Leber als Nierenersatz
Wie bereits erwähnt, muss bei einem Totalausfall der Nierenfunktion mit einem Anstieg fixer H+-Ionen von 40 - 80 mmol pro Tag gerechnet werden, also einem negativen BE von - 3 bis - 5 mmol/l pro Tag. Dieser Verlust kann vorübergehend, d. h. vor der Entscheidung zur Dialyse, aber auch während einer Dialyse, durch tägliche Zufuhr von 40 - 80 mmol HCO3-, z. B. parenteral oder enteral in Form säurestabiler Tabletten einerseits oder 15 - 30 mmol Zitrat andererseits ausgeglichen werden, die nach Metabolisierung 45 - 90 mmol HCO3- freisetzen.
Im Rahmen der Hämodialyse wird dem Patienten über die Spülflüssigkeit Azetat oder Bikarbonat zugeführt, bei der Peritoneal-Dialyse wird bevorzugt Laktat verwendet. Sobald Azetat oder Laktat zum Einsatz kommen, fungiert die Leber als Nierenersatzorgan.
