
Ketoacidose und Hypothermie
Diskussion der Arbeit: „Neuenfeldt T, Hopf HB: Erfolgreiche Behandlung einer extremen metabolischen Acidose mit ausgeprägter Hypothermie (Anaesthesist 2009; 58: 1113 - 118)“ durch R Zander (Physioklin), T Neuenfeldt und HB Hopf (Asklepios Klinik Langen, Fachabteilung für Anästhesie)
Der Fall:
Ein 41-jähriger Typ 1 Diabetiker kommt als Notfall mit extremer Ketoacidose, akzidenteller Hypothermie und Bewusstseinstrübung zur Aufnahme. Die wesentlichen Behandlungsziele waren: die Therapie der Ketoacidose unter Vermeidung eines Hirnödems, die Wiedererwärmung sowie die adäquate Flüssigkeits- bzw. Volumentherapie.
1. Behandlung der Ketoacidose unter Vermeidung eines Hirnödems
Problem: Die Ausbildung eines Hirnödems als gefürchtetste Komplikation eines hyperosmolaren bzw. ketoacidotischen Komas stand im Vordergrund der Therapie.
Klinische Praxis (nach Kitabchi et al.: Hyperglycemic crises in adult patients with diabetes: a consensus statement from the American Diabetes Association. Diabetes Care 2006; 29: 2739-2748): In den ersten 24 h wurden 13,9 l Flüssigkeit infundiert (Osmolalität in mosmol/kg H2O): Vom Notarzt 1,5 l hypotone Ringer-Azetat (256), dann 2,5 l isotone 0,9% NaCl (286) plus 4,5 l Ringer-Azetat (256) plus 5,1 l hypotone 5% Glukose (0 in vivo) plus 0,3 l extrem hypertone 1 molare Bikarbonatlösung (~ 2.000). Die mittlere Osmolalität der infundierten Flüssigkeit betrug 205 mosmol/kg H2O.
Physiologische Auswirkungen: Durch die Consensus orientierte Therapie wurde das extrazelluläre Flüssigkeitsvolumen (ECFV) von 15 l (75 kg KG angenommen) fast verdoppelt (28,9 l) und damit die Osmolalität im ECFV von 290 mosmol/kg H2O (Normalwert unterstellt) auf 248 mosmol/kg H2O extrem stark abgesenkt. Rechnet man den zu erwartenden osmotischen Ausgleich mit dem Intrazellularraum (ICFV) mit ein, so würde sich für ECFV (28,9 l) plus ICFV (30 l) zusammen eine Osmolalität von ca. 270 mosmol/kg H2O ergeben, eine ganz erhebliche extra- und intrazelluläre Hypoosmolalität. Diese Betrachtung vernachlässigt die CVVHDF.
Vorschlag: Die Messung der Osmolalität (mosmol/kg H2O) oder - ersatzweise - die von jedem BGA-Gerät berechnete Osmolarität (mosmol/l) sollte zur Therapiekontrolle verwendet werden, da ein zu starkes (iatrogenes) Absenken der Osmolalität/Osmolarität bei der Vermeidung eines Hirnödems nicht hilfreich ist. Im übrigen ist die Verwendung von sog. Physiologischer Kochsalz-Lösung generell zu hinterfragen, da NaCl 0,9% unphysiologisch zusammengesetzt ist (Natrium-Gehalt zu hoch, Cl-Gehalt viel zu hoch, kein Kalium, kein Calcium). Bezüglich Menge und Zusammensetzung der Infusionslösungen siehe auch unter Punkt 3.
2. Beatmung unter Hypothermie
Die Thematik "Hypothermie" ist offensichtlich hoch aktuell, allein im Anaesthesisten wurden dazu seit 2004 viele Beiträge publiziert (Dueck et al., 2004; Scheidegger, 2005; Popp et al., 2005; Brüx et al., 2005; Schewe et al., 2005; Russo et al., 2005; Goertz, 2006; Schneider et al., 2006; Bräuer et al., 2006; Platzer et al., 2007; Bach et al., 2007; Hohlrieder et al., 2007; Zander, 2007).
Problem: Der Patient hat bei Aufnahme eine Körpertemperatur von 27,3 °C, die Beatmung unter Hypothermie erfordert die Kontrolle der Blutgase entweder nach dem so genannten Alpha-stat-Regime (Messung bei 37 °C) oder dem pH-stat-Regime (Messung bei Körpertemperatur).
Klinische Praxis: Die maschinelle Ventilation wurde nach dem Alpha-stat-Regime angepasst, d. h. in der Blutgasanalyse wurden pH-Wert und pCO2 bei 37 °C gemessen und sollten im physiologischen Normbereich liegen.
Physiologische Auswirkungen: Die Einstellung der Beatmung orientiert sich - wenn idealerweise vorhanden - am Kapnometer, die mögliche Kontrolle erfolgt über den Temperatur-korrigierten paCO2.
Beispiel: Ein auf petCO2 40 mmHg kapnometrisch beatmeter Patient mit einem BE von 0 mmol/l und einer Körpertemperatur von 25 °C zeigt (Zander, 2007),
- ohne Korrektur auf Körpertemperatur (25 °C) und Messung bei 37 °C, einen Methoden-bedingten paCO2 von 70 mmHg und daher einen pH von 7,25
- und mit Korrektur auf Körpertemperatur (25 °C) einen normalen paCO2 von 40 mmHg und daher einen pH von 7,40.
Für den aktuellen Patienten bedeutet dies:
- Befund bei Aufnahme (27,3 °C, also Korrektur für ~ 10 °C): pCO2 nicht 23,4 sondern 16,4 mmHg,
- bei einem Temperatur-unabhängigen BE von -33,9 mmol/l betrug dann der wahre pH 6,75 statt 6,63 (cHb mit 10 g/dl angenommen).
Damit wurde der Patient offensichtlich sehr stark hyperventiliert, eine Maßnahme, die unter den Gesichtspunkten Hirnödem und Kompensation der metabolischen Acidose mit hoher Wahrscheinlichkeit nicht schädlich war.
Vorschlag: Alternativ kann unter Hypothermie-Bedingungen der Temperatur-korrigierte pCO2 nach folgender Annahme errechnet werden: 1 °C entspricht 2,5 mmHg. Nimmt man den beschriebenen Patienten als Beispiel, käme man unter der Bedingung von 27 °C auf einen „wahren“ pCO2 von ca. 15 mmHg - eine sehr gute Annäherung. Jeder Blutgas-Analysator hat zwar die Möglichkeit, die bei 37 °C gemessenen Werte auf die Körpertemperatur des Patienten umzurechnen - die permanente Umstellung ist jedoch im Alltag nicht praktikabel und wird von einem Teil der Gerätehersteller ausdrücklich auch nicht empfohlen.
3. Adäquate Flüssigkeits- bzw. Volumentherapie
Problem: Die Flüssigkeitssubstitution ist von der Volumentherapie zu trennen, erstere soll Verluste des extrazellulären Raumes (ECFV) ausgleichen, letztere einen intravasalen Volumenmangel ersetzen. Die eingesetzten Lösungen unterscheiden sich daher nur noch bezüglich des Kolloids zur Aufrechterhaltung des kolloidosmotischen Druckes.
Klinische Praxis: Die Dehydratation und/oder Hypovolämie des Patienten bei Aufnahme wurde rein klinisch diagnostiziert, dabei wurde unterstellt, dass eine osmotische, hyperglykämische Diurese als Auslöser für beide Zustände anzunehmen ist. Die Flüssigkeitsbilanz des Patienten, ergänzt um die tägliche Urin-Ausscheidung, ist in der folgenden Abbildung dargestellt.
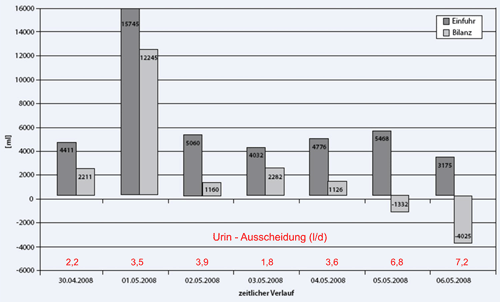
Physiologische Auswirkungen: Es ist bekannt, dass die maximale tägliche Urinausscheidung des Patienten bei exzessiver Flüssigkeitstherapie (5 - 50 l/d) mit hyperchlorämischen Lösungen (0,9 % NaCl, Ringer-Laktat) auf ca. 3 l limitiert ist (Mittelwert von 9 Serien 3,1 ± 0,7 l/d, nach Zander, Flüssigkeitstherapie 2009). Diese Angaben sind für den geschilderten Patienten auch unter Beatmungsbedingungen annähernd zutreffend. Die Diuresesteigerung ab dem 5. Tag ist Folge der dann verabreichten Diuretika. Jede intravenöse Flüssigkeitszufuhr über einen Betrag von ca. 3 Liter hinaus muss somit zu einer Hyperhydratation mit Zunahme des Körpergewichts führen, deren dramatische Folgen hinlänglich bekannt sind (Cotton et al., Shock 2006).
Vorschlag: Die Wahl der Infusionslösungen kann deutlich verbessert werden, indem ausschließlich balancierte Lösungen eingesetzt werden (Zander, 2009): Keine hypotonen Lösungen (Ringer-Azetat), keine hyperchlorämischen (0,9 % NaCl) oder freies Wasser (5 % Glukose), sondern isotone Lösungen (290 ± 10 mosmol/kg H2O) mit einem physiologischen Elektrolytmuster von Natrium, Kalium, Calcium und Chlorid sowie einem physiologischen Säure-Basen-Status mit metabolisierbaren Anionen als Bikarbonatersatz (BEpot von 0 ± 10 mmol/l). Die Infusion dieser Lösungen kann – außer beim Volumen – keine iatrogenen Störungen des Elektrolyt-, Säure-Basen- und Gerinnungs-Status verursachen. Allerdings ist in der Ketoacidose die Zufuhr von Glukose zur Durchbrechung der Ketonkörperproduktion zwingend – insofern wird sich auch mit Einsatz von balancierten Infusionslösungen eine wenn auch geringere Absenkung der Osmolalität nicht vermeiden lassen. Vermutlich kann aber durch Verwendung solcher balancierter Lösungen der Flüssigkeitsbedarf insgesamt vermindert werden.
Mainz/Langen, 09. August 2010
