
Hyperosmolalität
Vorwort
Zur Einstimmung auf das Thema wird folgender Überblick gegeben.
Nach einem akuten Verlust bis ca. 20 % des Blutvolumens erfolgt eine Sympathicus-Aktivierung zur Restitution des Plasmavolumens.
Kommt es darüber hinaus zum Volumenmangel-Schock, wirkt die dabei auftretende Hyperosmolalität im Schock als treibende Kraft für die Restitution des Plasmavolumens. Sie sorgt innerhalb weniger Minuten für eine Wasserdiffusion aus dem intracelluären (ICFV) in das extracelluläre (ECFV) Kompartiment bis zum Ausgleich beider Osmolalitäten. Neben der Glukose (Hyperglykämie) werden für die Hyperosmolalität auch unbekannte Substanzen, „unmeasured anions“ (UMA), verantwortlich gemacht. Auch bei schwer verletzten Patienten ohne Blutverlust wird die Hyperosmolalität beobachtet. Es wird bezweifelt, dass die Hyperosmolalität ein effektiver „Notfall-Mechanismus des Organismus“ ist.
Bei akutem, nicht chronischem, vital bedrohlichen Volumenmangel ist eine hyperonkotische Infusionslösung geeignet, die schnellstmögliche Wiederauffüllung des intravasalen Flüssigkeitsvolumens (IVFV) unter Einbeziehung von Flüssigkeitsreserven des Interstitiums zu erzielen.
Für den hämorrhagischen Schock beim Menschen ist zu prüfen, ob es einen klinisch relevanten Vorteil im Hinblick auf die Mortalität nach Einsatz von hypertoner NaCl-Lösung gibt. Ebenso, ob es einen intravasalen Volumeneffekt im Sinne einer small volume resuscitation bei der Reanimation gibt.
Sollen hypertone NaCl-Lösungen zur Therapie der intrakraniellen Hypertension (ICP) verwendet werden, ist nur ein Bolus geeignet, einen osmotischen Gradienten aufzubauen. Der von mehreren Autoren angegebene Grenzwert der gemessenen Osmolalität von 320 mosmol/kg H2O wird überprüft. Die in zahlreichen Reviews und Metaanalysen vertretene sehr zurückhaltende Bewertung der hypertonen NaCl-Lösung zur ICP-Senkung wird kommentiert.
Der Einsatz hyperchlorämer Infusionslösungen sollte unterbleiben, weil die Hyperchlorämie die Nierenfunktion negativ beeinflusst.
In einem Anhang zur Osmolarität vs. Osmolalität wird gezeigt, dass die Begriffe Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) und ihre entsprechenden Zahlenwerte von vielen Autoren verwechselt werden.
Restitution des Plasmavolumens
Wenn einem Tier, üblicherweise dem splenektomierten Hund, innerhalb von ca. 20 min 20 bis 50 % des Blutvolumens entnommen werden (15 - 35 ml/kg KG) [2, 9], dann werden davon in den ersten Minuten 35 % des Verlustes ausgeglichen (0,25 ml/kg KG pro Minute) [2] und in den ersten 6 Stunden sogar 87 % [9]. Als eine der Ursachen wird eine ausgeprägte intestinale Vasokonstriktion beschrieben, auf zirkulierendes Angiotensin und Vasopressin zurückzuführen [6].
Die Befunde am Menschen sind sehr heterogen.
- Ein schneller (arterieller) Blutverlust erzeugt etwa die doppelte Restitution im Vergleich zu einem langsamen (venösen) Verlust [7, 8, 10], der Rekord lag bei ca. 160 ml/h nach einer arteriellen Blutung;
- Es werden keine nennenswerten Hypotensionen beobachtet [1];
- Die Restitution in den ersten 6 Stunden erfolgt deutlich besser als in den Zeiten danach [3, 8].
Das entzogene Blutvolumen bei gesunden Probanden betrug 10 [3, 7] bis 20 % [1, 5, 8]. In den ersten Stunden nach Blutung erfolgte die Restitution des Blutverlustes mit ca. 10 ml/h [1], ca. 20 ml/h [3, 5], ca. 60 ml/h [7] und 50 ml/h nach venöser bzw. 100 ml/h nach arterieller Blutung [10].
Die Interpretation [4] der Restitution des Plasmavolumens lautet:
- Die erste Phase beginnt mit einer direkten Sympathicus-Antwort auf den Blutverlust, abhängig von der Höhe des Blutverlustes. Diese Phase wird eingeleitet durch den Abfall des Kapillardruckes als Folge der arteriolären Vasokonstriktion und durch den Abfall des arteriellen Druckes. Wenn der Kapillardruck fällt, strömt eine proteinfreie Flüssigkeit aus dem Interstitium in das Blut ein. Dies beginnt nach 30 min und dauert ca. 6 h.
- Die zweite Phase, hier nicht diskutiert, führt zu einer Restitution der Plasmaproteine, vornehmlich des Albumins. Dies basiert auf einer Neuverteilung des Albumins, nicht auf einer Synthese, die erst etwa 2 Tage nach der Blutung beginnt. Die Synthese macht nur ca. 30 % der Albumin-Restitution aus.
Fazit Restitution des Plasmavolumens
- Ein schneller Verlust innerhalb einer Stunde bis zu ca. 20 % des Blutvolumens wird infolge einer Sympathicus-Aktivierung in Minuten mit maximal 150 ml interstitieller, proteinfreier Flüssigkeit ohne Hypotension ersetzt, unter anderem zurückzuführen auf eine ausgeprägte intestinale Vasokonstriktion mit zirkulierendem Angiotensin und Vasopressin.
Literatur
- Adamson J, Hillman RS
Blood volume and plasma protein replacement following acute blood loss in normal man
JAMA 1968; 205: 609 - 612 - Adolph EF, Gerbosi MJ, Lepore MJ
The rate of entrance of fluid into the blood in hemorrhage
Am J Physiol 1933; 104: 502 - 517 - Dagher FJ, Lyons JH, Lister J, Moore FD
Hemorrhage in normal man: the effects of angiotensin
J Surg Res 1966; 6: 66 - Gann DS
Endocrine control of plasma protein and volume
Surg Clin North Am 1976; 56: 1135 - 1145 - Lister J, McNeill IF, Marschall VC , Plzak LF, Dagher FJ, Moore FD
Transcapillary refilling after hemorrhage in normal man: Basal rates and volume; effect of norepinephrine
Ann Surg 1963; 158: 698 - 712 - Mc Neill JR, Stack RD, Greenway CV
Intestinal vasoconstriction after hemorrhage: Role of vasopressin and angiotensin
Am J Physiol 1970; 219: 1342 - 1347 - Moore FD, Dagher FJ, Boyden CM et al.
Hemorrhage in normal man: I. Distribution and dispersal of saline infusions following acute blood loss
Ann Surg 1966; 163: 485 - 504 - Skillman JJ, Awward H, Moore FD
Plasma protein kinetics of the early transcapillary refill after hemorrhage
Surg Gynecol Obstet 1967; 125: 983 - 996 - Skillman JJ, Eltringham WK, Goldensen RH et al.
Transcapillary refilling after hemorrhage in the splenectomized dog
J Surg Res 1968; 8: 57 - 67 - Skillman JJ, Moore FD
Volume-regulatory and endocrine relationships after blood loss in man
Ann N Y Acad Sci 1968; 150: 639 - 648
Hyperosmolalität zur Restitution des Plasmavolumens
Boyd und Mansberger [3] haben die Hyperosmolalität als treibende Kraft für die Restitution des Plasmavolumens nach einem Blutverlust am Tier und am Menschen ausführlich beschrieben. Als Kandidaten für die Hyperosmolalität kommen die Glukose (Hyperglykämie) und die später auch als „unmeasured anions“ (UMA) bezeichneten unbekannten Substanzen in Frage.
Ihre erste Bedeutung erlangen die UMA bezüglich der Hyperosmolalität, also unbekannte Substanzen, deren Wert sich aus der Differenz zwischen gemessener und berechneter Osmolalität ergibt: Die über die Gefrierpunkts-Erniedrigung gemessene Plasma-Osmolalität (Normalwert 288 mosmol/kg H2O) fällt deutlich höher aus als der – damals – aus den Konzentrationen von Natrium, Harnstoff und Glukose berechnete Wert, von den Erstbeschreibern „mOsm-D“ bezeichnet [3, 4], heute eher als „osmolale Lücke“ (OL) bekannt.
Hier ist der 1. methodische Hinweis angezeigt:
- Glukose führt nicht zu einer osmolalen Lücke, da sie bei beiden Verfahren erfasst wird, sie wird aber sehr wohl für einen Großteil der Hyperosmolalität verantwortlich gemacht (s. u.).
- Laktat wird bei der herkömmlichen Berechnung der Osmolalität nicht berücksichtigt, es kann nicht zur Hyperosmolalität beitragen, weil es im Allgemeinen quantitativ vom Bikarbonat des Plasmas kompensiert wird. Auch formal kann es nicht als UMA bezeichnet werden, weil es heute üblicherweise gemessen werden kann.
In ihren klassischen Untersuchungen haben Boyd und Mansberger [3] überlebende und verstorbene Hunde nach einer Blutung mit Hypotension über 2 h auf 30 mmHg wie folgt differenziert (Zahlen gerundet): Wenn der Hct von 41 bzw. 45 % auf 29 bzw. 30 % abgefallen ist, dann steigt die gemessene Osmolalität bei den Überlebenden auf 339 und die berechnete auf 321 mosmol/kg H2O (OL = 18), bei den Verstorbenen allerdings gemessen auf 347 und berechnet auf 309 mosmol/kg H2O (OL= 38). Es ist offensichtlich, dass die osmolale Lücke (OL), das Maß für die unbekannten Substanzen (UMA), bei den verstorbenen Tieren deutlich größer ausfällt als bei den überlebenden Tieren.
Ihre zweite Bedeutung erlangen UMA bezüglich des Base Excess (BE, mmol/l): Es handelt sich um einen Betrag unbekannter Säure-Anionen, der den BE des Blutes messbar über die typischerweise proportionale Laktat-Konzentration des Plasmas (z. B. beim Sportler) ansteigen lässt. Hier der Link zu einer entsprechenden Publikation.
Befunde am Tier
Bereits 1933 wurde über die Messung des Wassergehalts (Trocknung) von Blut und Geweben an splenektomierten Hunden nachgewiesen, dass es innerhalb von 4 - 20 Minuten nach einer akuten Blutung zu einer deutlichen Plasmaverdünnung aufgrund eines Wassereinstroms aus den Geweben kommt [2]. Die für die Plasmaverdünnung verantwortliche, hormonell bedingte extracelluläre Hyperosmolalität zusammen mit dem Abfall des Kapillardrucks infolge Vasokonstriktion führt zur Restitution des Blutvolumens [11].
Die Hyperosmolalität, gemessen über die Gefrierpunks-Erniedrigung (GPE), ist ein wichtiger Regulator des extrazellulären und damit des Plasma-Volumens, der einen osmotisch bedingten Wassereinstrom aus dem Gewebe (ICFV) in das ECFV und damit IVFV bedingt [16]. Bereits 5 min nach Blutverlust ist die Plasma-Hyperosmolalität nachweisbar und ist proportional zur Höhe des Blutverlustes bis zu 22,5 ml/kg [6]. Diese schnell nachweisbare Plasma-Hyperosmolalität wird vornehmlich durch eine adrenerge Glukose-Freisetzung aus der Leber verursacht. Dafür werden 3 Mechanismen verantwortlich gemacht: Katecholamin-Freisetzung aus der Nebenniere, direkter Sympathikusreiz an die Leber und eine Glucagon-Freisetzung aus dem Pankreas [15].
Gezielte arterielle und venöse Blutentnahmen haben die Quellen der für die Hyperosmolalität verantwortlichen Substanzen zu definieren versucht: 20 min nach einer hämorrhagischen Hypotension auf 50 mmHg wurde ein Anstieg der Osmolalität um 20 mosmol/kg H2O nachgewiesen, der vor allem auf eine Hyperglykämie zurückgeführt werden konnte. Diese Anstiege wurden zuerst arteriell nachgewiesen, erst nach 60 min im Gleichgewicht auf der venösen Seite, wodurch eine Freisetzung aus dem Muskel ausgeschlossen werden konnte. Somit stammt die Glukose aus der Leber, die Insulin-Konzentration blieb dabei gleich. Die Hyperosmolalität soll danach für eine Vasodilatation im Intestinalkreislauf verantwortlich sein [15]. Der Anstieg der Osmolalität erscheint somit zuerst im Splanchnikusgebiet, erst später im restlichen Kreislauf [11]. Wird das Intestinum experimentell entfernt, ist die Plasma-Dilution deutlich vermindert [2].
Schon nach 20 min Hypotension auf 30 mmHg nimmt die Osmolalität um 29 mosmol/kg H2O zu, die Glukosekonzentration um 30 mmol/l, die Laktatkonzentration um 7 mmol/l und die Natrium-Konzentration um 9 mmol/l ab [15]. Letzteres als Ausdruck des Wassereinstroms aus dem ICFV, ein Befund der im Widerspruch zu denen anderer Autoren steht (s- u.).
Andere Autoren machen einen simultanen Anstieg von Cortison für die Hyperosmolalität verantwortlich [6, 12, 19, 20]. Angeblich gehen 60 - 70 % der post-hämorrhagischen Hyperosmolalität auf die Glukose zurück [9], bei anderen Autoren bis zu 90 % [13].
So wird eine strenge Korrelation zwischen der Glukose-Konzentration und dem Hämatocrit-Abfall nach Blutung gefunden: Vom Normalwert von 5 mmol/l Glukose-Konzentration und einem Hct von 47 % fällt der Hct infolge Wassereinstroms auf 33 % ab, wenn die Glukose-Konzentration 40 mmol/l erreicht [9].
Trotz nachgewiesener Hyperosmolalität kann der Anstieg der Glukose-Konzentration ausbleiben, wenn die Tiere mindestens 24 Stunden oder Tage vor dem Versuch gefastet haben [6, 9, 12, 19].
Befunde am Menschen
Bei schwer verletzten Patienten wird das Phänomen der Hyperosmolalität auch beobachtet, die bei Überlebenden reversibel und bei Verstorbenen irreversibel ist. Damit werden Substanzen erfasst, die im Falle der Irreversibilität eine negative Prognose signalisieren. Ihre Quantifizierung erfolgt über eine deutliche Diskrepanz zwischen der gemessenen und der berechneten Osmolalität, die osmolale Lücke (OL), ursprünglich als „mOsm-D“ bezeichnet [3]. Bei der Messung werden somit unbekannte (unmeasured) Substanzen erfasst, die in die Rechnung, weil unbekannt, nicht eingehen können.
An dieser Stelle ist der 2. methodische Hinweis erforderlich:
- Die Berechnung der OL erfolgte zur damaligen Zeit üblicherweise mit der Formel
cNatrium x 1,86 + cHarnstoff + cGlukose [5]. Das hat zur Konsequenz, dass für das Normal-Plasma mit einer gemessenen Osmolalität von 288 mosm/kg H2O ein berechneter Wert von nur 274 erhalten wird (142 x 1,86 + 5 + 5) mit der Folge, dass im Normalfall schon eine OL von 14 mosmol/kg H2O erhalten wird. Dies gilt es zu berücksichtigen. - Zur Ermittlung der korrekten OL würde man heute eine optimale Formel zur Berechnung der Osmolalität verwenden.
Die Autoren geben einen Grenzwert von 40 mosmol/kg H2O für die OL (mOsm-D) an, wird dieser überschritten, dann sollten die Patienten innerhalb kürzester Zeit sterben [5].
Die gleiche Arbeitsgruppe [4] lieferte für 111 schwer verletzte Patienten wichtige Daten, die sich auf 12 Verstorbene und 16 Überlebende beziehen, und zwar initial und final. Aus den Angaben der gemessenen Osmolalität und der Laktat-Konzentration sowie der berechneten mOsm-D (OL) wurden die Werte wie folgt korrigiert: Die gemessene Osmolalität wurde um das miterfasste Laktat vermindert, ebenso die das Laktat miterfassende OL, um die einzelnen Fraktionen dann einzeln aufzuführen.

Es ist offensichtlich, dass die Osmolalität bei den Überlebenden von initial nach final abnimmt, ebenso die Laktat-Konzentration und die osmolale Lücke. Bei den Verstorbenen hingegen bleiben alle 3 Werte von initial nach final deutlich erhöht. Dies gilt nicht nur für die osmolale Lücke mit 79 mosmol/kg H2O und folglich für die Osmolalität mit 365 mosmol/kg H2O sondern auch für die Laktat-Konzentration mit 18 mmol/l.
Damit sind zusätzlich zur prognostisch wichtigen Laktat-Clearance zwei weitere wichtige Prognose-Indikatoren hinzugekommen, die erhöhte osmolale Lücke und die konsekutive Hyperosmolalität.
Offensichtlich erscheinen im Plasma von schwer verletzten Patienten neben dem Hypoxie-Marker Laktat weitere unbekannte, vorläufig nicht messbare Substanzen, die die osmolale Lücke erhöhen und eine Hyperosmolalität verursachen.
Als Ergebnis einer retrospektiven Observations-Studie (228 chirurgische ICU-Patienten) wird gezeigt, dass die Hyperosmolalität und die Hypernatriämie von vielen geprüften biochemischen Parametern am besten mit der Mortalität korrelieren. Eine Hypoosmolalität wurde definiert als ein Wert < 275 mosmol/kg H2O (- 4,5 %) und eine Hyperosmolalität mit > 305 mosmol/kg H2O (+ 5,9 %) für mindestens 1 Tag auf der ICU. Im gleichen Sinne eine Hyponatriämie < 130 mmol/l (- 8,5 %) und eine Hypernatriämie > 150 (+ 5,6 %) mmol/l für mindestens 1 Tag auf der ICU [17], also im Mittel eine Abweichung von ~ ± 6 %.
Die Ergebnisse sind in den beiden folgenden Abbildungen wiedergegeben.


Damit wird klar, dass sowohl eine Hypernatriämie als auch eine Hyperosmolalität zu einer erheblichen Erhöhung der Mortalität auf der ICU mit verschlechtertem Langzeitverlauf führen.
Die Befunde über die Hypernatriämie erscheinen auf den ersten Blick insofern verwirrend, als die Natrium-Konzentration nach Blutung im Tierversuch (s.o.) nicht zu sondern abnimmt [15], ein logischer Befund, weil das einströmende Wasser aus dem ICFV auch das Natrium verdünnen sollte.
Trotzdem scheint doch die Änderung der Natrium-Konzentration ein wichtiger Prognose-Indikator zu sein, wie die folgende Abbildung verdeutlichen soll:
Die Natrium-Konzentration bei Aufnahme (!) auf der Intensivstation (IST) hat offensichtlich einen großen Einfluss auf die Mortalität auf der Intensivstation (IST) bzw. im Krankenhaus (KH). Dies gilt für immerhin 17,7 % der Patienten mit einer Hyponatriämie sowie 6,9 % der Patienten mit einer Hypernatriämie [10].
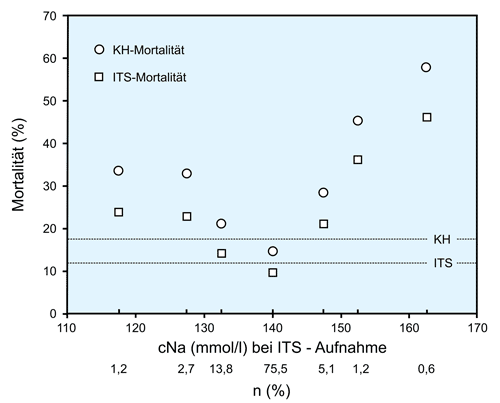
Eine prospektive Studie an 101 Traumapatienten ohne Schock kommt zu ähnlichen Ergebnissen bezüglich der Hyperosmolalität: Hier korrelieren, direkt nach Krankenhaus-Aufnahme, die Osmolalität und die Glukose-Konzentration mit der Schwere der Verletzung (ISS, Injury Severity Score), nicht allerdings die Cortison-Konzentration [18]. Allerdings wurde bei knapp 45 % dieser Patienten Alkohol (ETOH) im Blut nachgewiesen, der die Osmolalität deutlich erhöht.
Dies erfordert den 3. methodischen Hinweis:
- Gemäß einer Zusammenstellung verschiedener Daten kann man einen Zusammenhang zwischen der Blut-Ethanol-Konzentration und der osmolalen Lücke wie folgt definieren:
Blut-Ethanol (‰) x 32,0 = osmolale Lücke im Plasma (mosmol/ kg H2O).
Daraus ergibt sich zum Beispiel, dass eine ETOH-Konzentration von 1 ‰ einer OL von 32 mosmol/kg H2O entspricht. - Bei 565 Traumapatienten konnte eine eindeutige Korrelation zwischen Blut-ETOH und Osmolalität prospektiv nachgewiesen werden [8].
Die Ergebnisse sind in den beiden folgenden Abbildungen wiedergegeben.

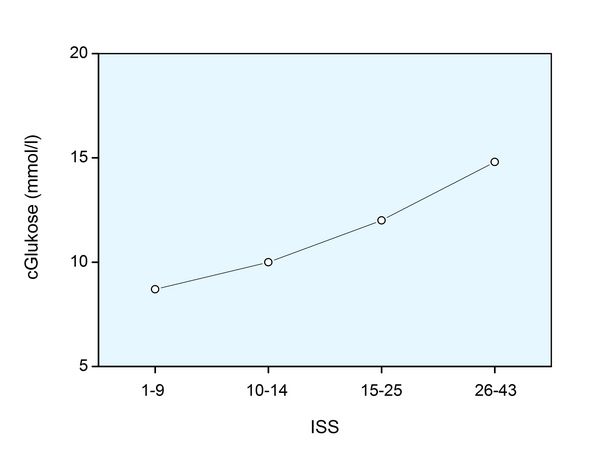
Es ist offensichtlich, dass der Anstieg der Glukosekonzentration und der Osmolalität als Prädiktoren der Verletzungs-Schwere eingesetzt werden können.
Die Differenz zwischen berechneter und korrigierter gemessener Osmolalität (OL) war – auch bei den ETOH-negativen Patienten – dem ISS proportional. Diese Differenz repräsentiert die Menge der nicht gemessenen, gelösten Stoffe im Blut (UMA), d.h. auch wenn Glukose und Alkohol die Osmolalität erhöhen, sind sie nicht für die Gesamterhöhung der Osmolalität verantwortlich.
Wenn man für die einzelnen ISS-Stufen eine Auswertung der beiden Abbildungen zusammen vornimmt, ergibt sich folgendes Bild:
Subtrahiert man von der gemessenen Osmolalität die Glukose-Konzentration (mmol/l = mosmol/kg H2O), dann erhält man für die 4 ISS-Stufen Werte für die UMA (gerundet) in mosmol/kg H2O von 9 (ISS 1 - 9), 23 (10 - 14), 28 (15 - 25) und 47 (26 - 43). Immerhin sind 47 mosmol/kg H2O ein ganz beträchtlicher Wert für die UMA bzw. die OL.
Aus dem Vergleich von 8 normalen Probanden, 17 Soldaten während Fasten vor dem Einsatz und 14 schwerverwundeten Soldaten ziehen Carey et al. [7] die folgenden Schlüsse: Im Vergleich zu Normalpersonen und Soldaten vor dem Einsatz mit normalen Glukose-Konzentrationen weisen Verwundete bei ihrer Einlieferung Hyperglykämien auf (Mittelwert 13,5 mmol/l mit einem Maximum von 23,3 mmol/l). Im schweren Schock (Laktat über 5,5 mmol/l, pH unter 7,3) lag die Glukose-Konzentration bei 19,5 mmol/l. Das NN-Mark wurde für diese Hyperglykämien bei normalen Plasma-Insulin-Konzentrationen verantwortlich gemacht.
Auch in späteren Publikationen wird die prognostische Aussagekraft der Osmolalität wiederholt belegt: Bei 27 beatmeten Polytraumapatienten ist die Osmolalität mit 303 deutlich niedriger als bei den Verstorbenen mit 319 mosmol/kg H2O [1] und retrospektiv ist die Osmolalität bei 928 ICU-Patienten der beste Prognosefaktor für die Krankenhausmortalität [14].
Interpretation
Die Interpretation jeder Hyperosmolalität im Plasma erfordert folgende Klarstellung:
Jede im Plasma gemessene Hyperosmolalität beschreibt einen Zustand nach erfolgtem Wasserausgleich zwischen dem intra- und extracellulären Raum (ECFV). Diese Wasserdiffusion aus dem ICFV erfolgt innerhalb von wenigen Minuten, treibende Kraft dafür ist eine Hyperosmolalität im ECFV, die erst nach Ausgleich der intra- und extracellulären Osmolalitäten zum Stillstand kommt.
Dies soll mit dem 4. methodischen Hinweis erläutert werden:
- Als Beispiel wird ein Patient mit 75 kg KG gewählt, dessen ECFV 15 l und ICFV 30 l beträgt. Hier kann man abschätzen, wieviel H2O verschoben worden sein muss, wenn die Osmolalität nach dem Ausgleich zugenommen hat.
Die Berechnung findet sich im Anhang unter Berechnungen für den Fall, dass die Osmolalität nach Ausgleich 320 mosmol/kg H2O betragen hat. - Diese Zahlen beziehen sich auf die Untersuchung einer Hyperosmolalität bis zu 318 mosmol/kg H2O (350 - 32 für 1 ‰ ETOH) [18], also praktisch identisch mit dem gewählten Beispiel von 320 mosmol/kg H2O im Anhang. Bei dieser gemessenen Osmolalität von 318 bzw. 320 mosmol/kg H2O, also Osmolalität im Gleichgewicht nach der H2O-Verschiebung, wurden 3 l von innen nach außen verschoben. Bezogen auf das Plasmavolumen, nämlich 20 % des ECFV, wären dies 0,6 l Zunahme des Plasmavolumens.
Es darf bezweifelt werden, dass dies ein effektiver „Notfall-Mechanismus des Organismus“ ist, einen Blutverlust von 0,6 l zu kompensieren. Der Hämatokrit wäre in diesem Falle nur von 40 auf 36 % abgefallen. Wenn von anderen Autoren [9] eine strenge Korrelation zwischen der Glukose-Konzentration und dem Hämatocrit-Abfall nach Blutung gefunden wurde, nämlich von 47 % bei 5 mmol/l Glukose-Konzentration auf 33 % bei einer Glukose-Konzentration von 40 mmol/l, dann zeigt dies, dass die resultierende Osmolalitäts-Zunahme von 35 mmosmol/kg H2O den Hct-Abfall nicht begründen kann. Offensichtlich müssen weitere UMA an diesem Prozess beteiligt sein.
Funktion der Leber zur Hyperosmolalität
Die besondere Funktion der Leber zum Thema Hyperosmolalität ist mit der folgenden Anmerkung zu berücksichtigen.
Im Rahmen der Glukoneogenese synthetisiert die Leber aus 2 Mol Laktat 1 Mol Glukose mit der Folge, dass der Betrag der laktatbedingten Hyperosmolalität halbiert wird. Unter diesem Gesichtspunkt erlangt die Hyperglykämie eine größere Bedeutung für die Hyperosmolalität als die Hyperlaktatämie.
Fazit Hyperosmolalität zur Restitution des Plasmavolumens
- Die Hyperosmolalität über den Normalwert des Plasmawertes von 288 mosmol/kg H2O hinaus gilt als treibende Kraft für die Restitution des Plasmavolumens nach einem Blutverlust. Sie sorgt innerhalb weniger Minuten für eine Wasserdiffusion aus dem ICFV in das ECFV und damit in das Plasma, die erst nach Ausgleich der intra- und extracellulären Osmolalitäten zum Stillstand kommt. Jede im Plasma gemessene Hyperosmolalität beschreibt somit einen Zustand nach erfolgtem Wasserausgleich.
- Neben der Glukose (Hyperglykämie) werden für die Hyperosmolalität auch unbekannte Substanzen, „unmeasured anions“ (UMA), verantwortlich gemacht, die beim Vergleich von gemessener und berechneter Osmolalität als osmolale Lücke (OL) auftauchen. Handelt es sich bei den UMA um unbekannte Säure-Anionen, dann wird der Base Excess (BE, mmol/l) messbar um einen Betrag erhöht, der über der proportionalen Laktat-Konzentration des Plasmas (z. B. beim Sportler) liegt. UMA im Plasma können daher als Osmolalität gemessen > berechnet oder als BE > cLaktat erfasst werden.
- Da Glukose bei beiden Osmolalitätsverfahren erfasst wird, führt sie nicht zu einer OL, sie wird aber sehr wohl für einen Großteil der Hyperosmolalität verantwortlich gemacht. Die Hyperglykämie ist Folge einer adrenergen Glukose-Freisetzung aus der Leber. Anhand des Hämatokrit-Abfalls nach einer Blutung kann belegt werden, dass die Hyperglykämie allein nicht ausreicht, diesen Abfall zu begründen, d.h. weitere UMA müssen dafür verantwortlich gemacht werden.
- Auch bei schwer verletzten Patienten ohne Blutverlust wird die Hyperosmolalität beobachtet, die bei Überlebenden reversibel und bei Verstorbenen irreversibel ist, quantifiziert über die OL. Damit wird die Hyperosmolalität und die konsekutive erhöhte OL zu einem wichtigen Prognose-Indikator, ein Grenzwert der OL von über 40 mosmol/kg H2O soll letal sein.
- Neben dem Hypoxie-Marker Laktat erscheinen im Plasma schwer verletzter Patienten weitere unbekannte, vorläufig nicht messbare Substanzen, die eine Hyperosmolalität plus OL verursachen. Wie die Laktat-Clearance kann die Rückbildung der OL als günstige Prognose interpretiert werden.
- Es ist fraglich, ob die neben der Hyperglykämie plus Hyperosmolalität beschriebene Hypernatriämie zu einer erheblichen Erhöhung der Mortalität auf der ICU führt, weil das einströmende Wasser aus dem ICFV eigentlich das Natrium verdünnen sollte.
- Auch in neueren Publikationen wird die auf der ICU gemessene Hyperosmolalität als Prognose-Indikator für die Mortalität bezeichnet. Es darf daher bezweifelt werden, dass die Hyperosmolalität ein effektiver „Notfall-Mechanismus des Organismus“ ist, einen Blutverlust zu kompensieren.
Literatur
- Abel M, Vogel WM
Osmolalitätsparameter und Nierenfunktion polytraumatisierter Intensivpatienten
Infusionsther 1982; 9: 261 - 264 - Adolph EF, Gerbasi MJ, Lepore MJ
The rate of entrance of fluid into the blood in hemorrhage
Am J Physiol 1933; 104: 502 - 517 - Boyd DR, Mansberger AR Jr
Serum water and osmolal changes in hemorrhagic shock: An experimental and clinical study
Amer Surg 1968; 34: 744 - 749 - Boyd DR, Folk FA, Condon RE et al.
Predictive value of serum osmolality in shock following major trauma
Surg Forum 1970; 21: 32 - 33 - Boyd DR, Addis HM, Chilimindris C et al.
Utilization of osmometry in critically ill surgical patients
Arch Surg 1971; 102: 363 - 372 - Byrnes GJ, Pirkle JC Jr, Gann DS
Cardiovascular stabilization after hemorrhage depends upon restitution of blood volume
J Trauma 1978; 18: 623 - 627 - Carey LC, Lowery BD, Cloutier CT
Blood sugar and insulin response of humans in shock
Ann Surg 1970; 172: 342 - 350 - Champion HR, Baker SP, Benner C et al.
Alcohol intoxication and serum osmolality
Lancet 1975; 1 (7922): 1402 - 1404 - Friedman SG, Pearce FJ, Drucker WR
The role of blood glucose in defense of plasma volume during hemorrhage
J Trauma. 1982 Feb;22: 86 - 91 - Funk GC, Lindner G, Druml W, Metnitz B, Schwarz C, Bauer P, Metnitz PG
Incidence and prognosis of dysnatremias present on ICU admission
Intensive Care Med 2010; 36: 304 - 311 - Gann DS, Carlson DE, Byrnes GJ et al.
Role of solute in the early restitution of blood volume after hemorrhage
Surgery 1983; 94: 439 - 446 - Gann DS, Pirkle JC Jr
Role of cortisol in the restitution of blood volume after hemorrhage
Am J Surg. 1975; 130: 565 - 569 - Hobler KE, Hadaway CE, Bleyl KL et al.
Solute change during hypovolemic shock in the pig
Fed Proc 1978; 37: 775 - Holtfreter B, Bandt C, Kuhn SO et al.
Serum osmolality and outcome in intensive care unit patients
Acta Anaesthesiol Scand 2006; 50: 970 - 977 - Järhult J, Holmberg J, Lundvall J et al.
Hyperglycemic and hyperosmolar responses to graded hemorrhage
Acta Physiol Scand 1976; 97: 470 - 475 - Järhult J
Osmotic fluid transfer from tissue to blood during hemorrhagic hypotension
Acta Physiol Scand 1973; 89: 213 - 226 - Kaukinen L, Pasanen M, Kaukinen S
Outcome and risk factors in severely traumatized patients
Ann Chir Gynaecol 1984; 73: 261 - 267 - Kenney PR, Allen-Rowlands CF, Gann DS
Glucose and osmolality as predictors of injury severity
J Trauma 1983; 23: 712 - 719 - Pirkle JC Jr, Gann DS
Restitution of blood volume after hemorrhage: role of the adrenal cortex
Am J Physiol 1976; 230: 1683 - 1687 - Pirkle JC Jr, Gann DS
Expansion of interstitial fluid is required for full restitution of blood volume after hemorrhage
J Trauma 1976; 16: 937 – 947
Hyperonkotische Infusionslösungen
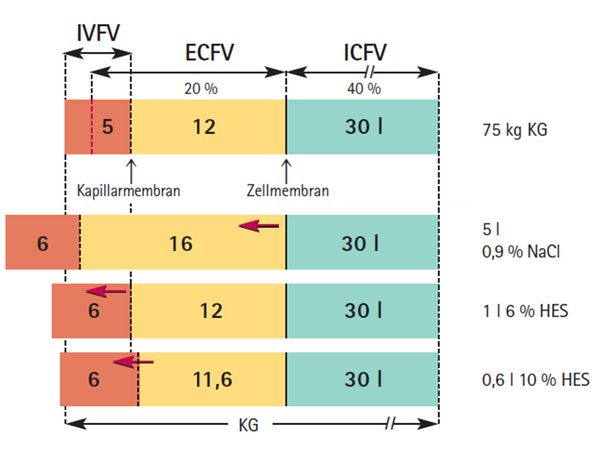
Hyperonkotische Lösungen, zum Beispiel 10% HES (MW 130/0,4) mit einer initialen Volumenwirkung von 166 %, sind in der Notfallmedizin als einmalige Gabe zu empfehlen [3].
Wie in der Abb. oben dargestellt (unterste Zeile) wird mit nur 0,6 l hyperonkotischer Lösung ein intravasaler Volumeneffekt von 1 l auf Kosten des ECFV (- 0,4 l) erzielt. Voraussetzung ist ein entsprechend vorhandenes interstitielles bzw. auch intrazelluläres Flüssigkeitsvolumen.
Die hyperonkotische Lösung ist erforderlich, um bei akutem (nicht chronischem), vital bedrohlichem Volumenmangel die schnellstmögliche Wiederauffüllung des IVFV unter Einbeziehung von Flüssigkeitsreserven des Interstitiums zu erzielen.
Der Vorteil dieser Akut-Therapie der Hypovolämie besteht darin, dass die schnelle physiologische Volumenregulation unterstützt wird, also Flüssigkeits-Verschiebung von extra- nach intravasal mit – abgesehen vom Albumin – physiologisch zusammengesetzter Flüssigkeit einschließlich HCO3. Im Gegensatz zur physiologischen Reaktion mit Senkung des KOD sorgt eine hyperonkotische Infusionslösung hingegen dafür, dass diese Volumenverschiebung unter Aufrechterhaltung des KOD unterstützt wird.
Eine Anwendung über mehrere Tage, wie in einer Studie geschehen [1], ist logischerweise kontraindiziert [2]. Beim Einsatz dieser hyperonkotischen Lösungen sind Präparate in balancierter Lösung einer NaCl-basierten Lösung natürlich vorzuziehen, insbesondere deshalb, weil damit die Hyperchlorämie vermieden wird.
Fazit hyperonkotische Lösungen
- Eine hyperonkotische Lösung ist bei akutem (nicht chronischem) vital bedrohlichem Volumenmangel geeignet, die schnellstmögliche Wiederauffüllung des IVFV unter Einbeziehung von Flüssigkeitsreserven des Interstitiums zu erzielen.
Literatur
- Brunkhorst FM, Engel C, Bloos F, et al.
Intensive insulin therapy and pentastarch resuscitation in severe sepsis
N Engl J Med 2008; 358: 125 - 139 - Zander R, Boldt J, Engelmann L, et al.
Studienprotokoll der VISEP-Studie - Eine kritische Stellungnahme
Anaesthesist 2007; 56: 71 - 77 - Zander R
Anforderungen an einen optimalen Volumenersatz
Anästh Intensivmed 2009, 50: 348 - 357
Hypertone (hyperosmolale) NaCl-Lösungen
Prinzipielle Vorbemerkungen
- An dieser Stelle und auch im weiteren Verlauf, also SVR (small volume resusciation) im Rahmen der Reanimation einerseits und Therapie der intrakraniellen Hypertension (ICP) andererseits muss darauf hingewiesen werden, dass das Therapie-Prinzip darin besteht, einen osmotischen Gradienten zwischen dem extra- und dem intracellulären Kompartiment aufzubauen, der eine schnelle Wasser-Diffusion von innen nach außen bewirkt. Sobald der sofort zu erwartende Ausgleich der beiden Osmolalitäten vollzogen ist, besteht keine weitere Wasser-Diffusion, d.h. die Therapie ist abgeschlossen. Hierauf haben Autoren zu Recht ausdrücklich hingewiesen: „Fluid transfer from the intracellular space to the extracellular space will occur as long as the extracellular osmolality is higher than the intracellular osmolality“ [13].
- Eine kontinuierliche Infusion hypertoner Lösungen mit dem Ziel, die extracelluläre Hyperosmolalität aufrecht zu erhalten, ergibt somit keinen Sinn, weil nur eine Osmolalitäts-Änderung außen eine Wirkung erzeugen kann.
- Die einmalige Erhöhung der extracellulären Osmolalität mit dem Ziel, eine Wasserdiffusion von innen nach außen zu erzeugen, bietet zwei Therapieansätze:
Entweder soll primär das extracelluläre (ECFV) und damit sekundär das intravasale Flüssigkeitsvolumen (IVFV) erhöht werden, sogenannte SVR oder das Therapieziel besteht im Entzug von Flüssigkeit aus dem intracellulären Flüssigkeitsvolumen (ICFV) zur Entlastung eines Hirnödems mit Senkung des ICP. - Alle Überlegungen zur Therapie mit hypertonen Lösungen basieren darauf, dass die Osmolalitäten (mosmol/kg H2O) und nicht die Osmolaritäten (mosmol/l) in beiden Flüssigkeitsräumen ICFV und ECFV immer gleich sein müssen. Der Normalwert beträgt daher in beiden Kompartimenten, wie auch im Plasma, 288 mosmol/kg H2O (s.u. Berechnungen). Dieser Wert wird bei der üblichen Messung über die Gefrierpunkts-Depression erhalten, egal ob er im Vollblut oder im Plasma gemessen wird. Hypertone Lösungen sind daher mit ihrer Osmolalität zu definieren, wenn ihre Wirkung beschrieben werden soll.
Praxis
Am Beispiel eines Bolus von 250 ml einer 10 %igen NaCl-Lösung wird das Therapie-Prinzip einer hypertonen Infusionslösung anhand des folgenden Schemas erneut demonstriert.
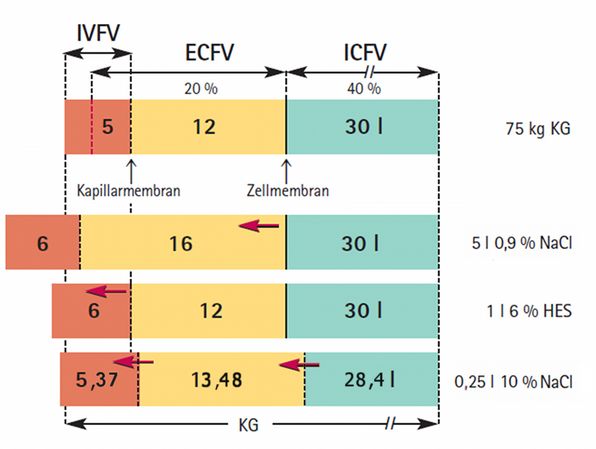
In der Abb. oben dargestellt werden die Verhältnisse bei einem Patienten von 75 kg KG.
Die Infusion von 0,25 l einer Lösung mit 3.289 mosmol/kg H2O erhöht die Osmoltät im ECFV von 288 auf 337 mosmol/kg H2O (Berechnung im Anhang). Diese Hyperosmolalität führt sofort zu einer Wasser-Diffusion aus dem ICFV in das ECFV, bis die beiden Osmolalitäten ausgeglichen sind. Der Wert liegt bei 304 mosmol/kg H2O. Dazu muss das ECFV 1,6 l aufnehmen und das ICFV hat dann um den gleichen Betrag von 30 auf 28,4 l abgenommen. Somit liegen nun im ECFV 1,6 + 0,25 also 1,85 l kristalliner Flüssigkeit vor, davon verbleiben im IVFV nur 20 % davon, also 0,37 l.
Nach der schnellen Infusion von 0,25 l NaCl 10 % landen im Gefäßbett nur 0,37 l. Dafür sind dann im Extravasalraum (EVFV) – ohne physiologische Relevanz – 1,48 l (80 %) gelandet.
Diese Bilanz ist ernüchternd: Statt mit 0,25 l einer 10 %igen NaCl-Lösung könnte der gleiche intravasale Volumen-Effekt mit einer schnellen (Druck-) Infusion einer balancierten kolloidalen Lösung von 0,37 l oder 1,85 l einer balancierten Elektrolytlösung erreicht werden.
Der pathophysiologische Nebeneffekt der Hyperchlorämie stellt sich aber für die hypertone NaCl-Lösung wie folgt dar (Berechnung s. Anhang):
Es werden wieder 0,25 l einer Lösung mit 1.724 mmol/l Chlorid infundiert, die Bilanz für Chlorid als perfektem Marker für den Extrazellularraum ergibt eine Konzentration von 118 statt 103 mmol/l. Vor dieser Hyperchlorämie muss wegen der nierenschädlichen Effekte ausdrücklich gewarnt werden.
Reanimation
Den aktuellen Anlass für diese Betrachtungen liefern Zitate aus einer Veröffentlichung der Arbeitsgemeinschaft Südwestdeutscher Notärzte e.V. (agswn März 2014):
„In den letzten Jahren stand für eine hyperosmolare (Erst-)Therapie von Volumenmangelzuständen („small volume resuscitation“, SVR) auf dem deutschen Markt das Präparat HyperHAES® (Fa. Fresenius-Kabi) zur Verfügung. Die Herstellerfirma hat nun auf die Zulassung mit Wirkung ab 3. März 2014 verzichtet und dieses Produkt vom Markt genommen. Eine identische oder ähnliche Infusionslösung steht in Deutschland derzeit nicht zur Verfügung. Die agswn bedauert diesen Schritt, da das Konzept der SVR in der Notfallmedizin einen festen Platz hat. HyperHAES® ist eine hyperosmolare, isoonkotische Lösung (250 ml NaCl 7,2%, HAES 6%). Der wesentliche Effekt im Sinne des Konzepts der SVR beruht auf der Hyperosmolarität der NaCl-Lösung. Vergleichbare Volumeneffekte dürften aber auch durch die Infusion von 200 ml NaCl 10% zu erzielen sein. Da die relativ geringe Menge des in den Kombinationspräparaten enthaltenen isoonkotischen Kolloids für das Konzept der SVR nicht relevant sein dürfte, scheint die Verwendung von NaCl 10% eine vertretbare und wirtschaftliche Alternative zu sein („Expertenmeinung“).“
Es dürfte klargeworden sein, dass die von der agswn vorgeschlagenen 200 ml von 10 % NaCl, keinen nennenswerten Volumeneffekt erzeugen können: Eine einmalige Gabe von 200 ml erzeugt einen Volumeneffekt von lediglich 1,5 l extracellulär, nämlich 0,2 l aus der Infusion plus 1,3 l aus der H2O-Diffusion vom ICFV in das ECFV.
Der Nebeneffekt der Hyperchlorämie macht nun 114 statt 103 mmol/l Chlorid-Konzentration aus, ein immer noch ganz beträchtlicher Wert (Berechnung s. Anhang).
Eine „grobe“ Literaturübersicht zur Therapie des hämorrhagischen Schocks mit hypertonen Lösungen ergibt das folgende Bild, wobei die (wenige) Literatur bewusst im zeitlichen Ablauf kommentiert wird.
Ein hämorrhagischer Schock wurde im Tierversuch nach ähnlichen Mustern erzeugt:
Ein Blutentzug mit einem mittleren arteriellen Druck von 40 oder 50 mmHg für 30 min [2] 90 min [1] oder sogar 120 min [3]. Wenn das gesamte entzogene Blut danach retransfundiert wurde, konnte das Überleben nur mit hypertonen Lösungen gesichert werden, während alle isotonen Lösungen von Bicarbonat, NaCl und Glukose ineffektiv waren [1].
Wurde fast die Hälfte des Blutvolumens entzogen (43 %) und danach nur 10 % des Verlustes entweder mit 0,9 % NaCl oder 2.400 mosmol/l (= 7,0 % NaCl = 2.289 mosmol/kg H2O) ersetzt, konnten optimale Ergebnisse erzeugt werden [2]: Schon mit 4 ml/kg KG hypertoner Lösung war das Überleben zu 100 % gesichert, der MAP und das HZV stabilisieren sich sofort, die Herzfrequenz bleibt bei 160/min stabil und der Mesenterialflow (Null während des Schocks) steigt über den Ausgangswert an [2]. Die Autoren weisen ausdrücklich darauf hin, dass keine wesentliche Ausdehnung des Plasmavolumens nachweisbar war, also nicht für das Überleben zu 100 % verantwortlich gemacht werden kann.
In ähnlichen Tierversuchen [3] werden den Tieren 50 % des Blutvolumens entzogen, was während des Schocks zu einer Reduktion des HZV von 40 - 50 % bei einer Zunahme des totalen peripheren Widerstandes um 20 - 30 % führt. Eine Bolus-Injektion direkt danach von nur 10 % des entzogenen Volumens (160 ml) von 0,9 % NaCl oder 2.400 mosmol/l NaCl (= 7,0 % NaCl) führt im Falle der hypertonen Lösung bereits nach 10 min zu einer Zunahme des Plasmavolumens um ca. 360 ml, eine Zunahme, die bei der 0,9 % NaCl-Lösung ausbleibt. Die Autoren schließen aus ihren Befunden, dass die Small-Volume-Injektion der hypertonen Lösung die Kreislauffunktion dramatisch ansteigen lässt, hervorgerufen durch die Zunahme des Plasmavolumens, die Zunahme des Herzzeitvolumens und die Reduzierung des totalen peripheren Widerstandes.
Die Autoren selbst [3] aber schränken den Effekt einer Zunahme des Plasmavolumens deutlich ein (s.u. Berechnungen): Aufgrund des osmotischen Gradienten sollen 710 ml von innen nach außen verschoben worden sein, zusammen mit den 160 ml zugeführten Volumens wären das dann 850 ml, von denen (nach den Autoren) die Hälfte im IVFV verblieben sein sollen. Von einem Volumeneffekt bei nur ca. 25 % des verlorenen Volumen, 425 ml in Relation zu den verlorenen 1.600 ml Blut, kann beim besten Willen nicht gesprochen werden, zumal es sich eigentlich (20 % von 850 ml) nur um 170 ml und damit ca. 10 % handeln dürfte.
Aus den Tierversuchen ergibt sich eine deutliche Diskrepanz zwischen einem nur minimalen Volumeneffekt einerseits und den offensichtlich positiven hämodynamischen Effekten andererseits.
Am Patienten hingegen war eine aktuelle Metaanalyse aus dem Jahre 2014 anhand von 6 randomisierten, prospektiven, kontrollierten Untersuchungen von ursprünglich 66 Publikationen nicht in der Lage, einen klinisch wichtigen Vorteil im Hinblick auf die Mortalität nach Einsatz von hypertoner NaCl-Lösung nachzuweisen, auch wenn ein signifikanter Anstieg von Blutdruck und Natriumkonzentration (erwartungsgemäß) belegt werden konnte [4].
Eine andere Studie untersucht den Einsatz von HyperHAES nicht beim Volumenmangelschock sondern beim plötzlichen Herztod (OHCA, out of hospital cardiac arrest) [5]. Betrachtet man hier die Ergebnisse an 169 HyperHAES-Patienten (HHS) im Vergleich zu 108 nicht HHS-Patienten, so lässt sich für diese Therapie eine sichere und effektive Option nachwiesen, sofern man ein besseres Kurzzeit-Überleben zum Maßstab nimmt, gemessen an einer Krankenhaus-Einlieferung mit Spontan-Circulation [5].
Hier wurden im Mittel 215 ml einer 7,2 %igen NaCl (in isoonkotischem HES), also 2.350 mosmol/kg H2O, eingesetzt [5]. Diese erzeugen im ECFV eine Osmolalität von 317, nach dem Ausgleich dann eine Osmolalität von 297,7 mosmol/kg H2O. Dieser Ausgleich erfordert eine osmotische Volumenverschiebung von 1,0 l von intra- nach extracellulär, damit landen extracellulär dann 1,215 l, von denen 0,243 l (20 %) im IVFV verbleiben. Es ist äußerst fraglich, ob die Zufuhr von 215 ml, und nach osmotischer Volumenverschiebung, 243 ml als eine intravasale Volumentherapie einzuordnen sind.
Fazit Reanimation
- Zusammenfassend ist für den hämorrhagischen Schock beim Menschen zu konstatieren, dass der Nachweis eines klinisch wichtigen Vorteils im Hinblick auf die Mortalität nach Einsatz von hypertoner NaCl-Lösung bisher fehlt, auch wenn ein signifikanter Anstieg des Blutdrucks belegt werden konnte. Ein intravasaler Volumeneffekt dürfte ausgeschlossen sein, die resultierende Hyperchlorämie mit ihrer negativen Wirkung auf die Nierenfunktion spricht gegen den Einsatz hypertoner NaCl-Lösungen.
Literatur
- Brooks DK, Williams WG, Manley RW, Whiteman P
Osmolar and electrolyte changes in haemorrhagic shock. Hypertonic solutions in the prevention of tissue damage
Lancet. 1963; 9; 1 (7280): 521 – 527 - Velasco IT, Pontieri V, Silva RE et al.
Hyperosmotic NaCl and severe hemorrhagic shock
Am J Physiol 1980; 239: 664 - 667 - Nakayama S, Sibley L, Gunther RA et al.
Small-volume resuscitation with hypertonic saline (2,400 mOsm/lLiter) during hemorrhagic shock
Circ Shock 1984; 13: 149 – 159 - Wang J-W, Li J-P, Song YL, Tan K, Wang Y, Li T, Guo P, Li X, Wang Y, Zhao QH
Hypertonic saline in the traumatic hypovolemic shock: meta-analysis
J Surg Res 2014; 191: 448 – 54 - Hahn C, Breil M, Schewe JC, Messelken M, Rauch S, Gräsner JT, Wnent J, Seewald S, Bohn A, Fischer M; Study Group German Resuscitation Registry
Hypertonic saline infusion during resuscitation from out-of-hospital cardiac arrest: a matched-pair study from the German Resuscitation Registry
Resuscitation 2014; 85: 628 – 636
Therapie der intrakraniellen Hypertension (ICP)
Prinzipielle Vorbemerkungen
- Zitat aus Intrakranieller Druck und Osmolalität von Infusionslösungen:
„Der in seiner Form nicht veränderbare Schädel beinhaltet drei inkompressible Flüssigkeitsräume, von denen nur zwei, nämlich Blut und Liquor, partiell nach außen verschoben werden können: 1350 ml (g) Gehirn inklusive 125 ml Blut und 145 ml Liquor. Jede Volumen-Änderung eines der drei Kompartimente muss mit einer identischen Änderung eines anderen Raumes beantwortet werden (Hirnödem, intrazerebrale Blutung, subdurales Hämatom, Tumor etc.). Die Compliance des ZNS beschreibt die Änderung des Blut- bzw. Liquor-Volumens bei Änderung des intrakraniellen Druckes (ICP), ausgedrückt in ml/mmHg. Sie wird als Kehrwert gemessen, Elastance (mmHg/ml) genannt, indem zum Beispiel 1 ml 0,9 % NaCl in die Schädelhöhle appliziert und der resultierende Anstieg des ICP gemessen wird. Damit wird klar, dass jede noch so kleine Volumenzunahme des ZNS zu einem Anstieg des ICP führen muss, bedingt durch die Verschiebung von Liquor oder Blut aus dem Schädel hinaus, was letztendlich zu einer Abnahme der Hirndurchblutung führt. Mit zunehmendem ICP nimmt die Compliance deutlich ab, weil die Volumenverschiebungen von Blut bzw. Liquor schnell limitiert sind. Der Normalwert der Compliance des ZNS beträgt ca. 0,5 ml/mmHg, das heißt, dass jede Volumenzunahme des ZNS um nur 1 ml mit einem Anstieg des ICP von 2 mmHg beantwortet werden muss. Dieser Anstieg des ICP nimmt mit weiterer Volumenzunahme überproportional zu, weil die Compliance des ZNS abnimmt.“ - Auf ein weiteres Faktum ist erneut mit einem Zitat hinzuweisen: “The acute osmotic disequilibrium created by a bolus of a hypertonic solution which drives the movement of water out of the brain is not created when a continuous infusion is used” [9].
- Folgende Überlegung ist zusätzlich wichtig: Gelingt es, eine osmotisch bedingte Volumenverschiebung aus dem Hirngewebe nach außen zu erzeugen, dann führt diese erst dann zu einer Abnahme des ICP, wenn das im ECFV angekommene Wasservolumen aus dem Schädel hinaus befördert worden ist, also vornehmlich auf dem Weg über das Blut, d.h. mit dem Plasma als Teil des ECFV. Zur Klarstellung einer vermuteten Unsicherheit scheint ein Zitat angebracht: Die Autoren fordern neben Daten über das geeignete Osmotherapeutikum, die optimale Dosis und die sicherste und effektivste Art der Zufuhr dann entscheidend, die Erforschung des "mechanism of osmotherapy in general“ [24].
Quantifizierung einer ICP-Senkung
Ein Ödem des Gehirns (1.080 g = ml) mit nur 1 ml Volumenzunahme sollte einen ICP-Anstieg von 2 mmHg bewirken, und umgekehrt, eine Volumenabnahme des Gehirns um 10 ml entspricht z.B. einer ICP-Senkung von 40 auf 20 mmHg.
Das Beispiel einer hyperosmolalen Therapie [18] zeigt, dass zumindest die Größenordnung einer solchen Bilanzierung manchmal zutrifft:
Nach einer mittleren Zufuhr von 45 ml einer NaCl-Lösung von 23,4 % entsprechend einer Osmolalität von 7.696 mosmol/kg H2O stellt sich im ECFV eine Osmolalität von 311 mosmol/kg H2O ein, die nach Verschiebung von 400 ml H2O einen Gleichgewichtszustand von 296 mosmol/kg H2O erreicht. Da 400 ml bezogen auf das ICFV von 30 l (75 kg KG) eine Volumenverschiebung von 1,33 % ausmachen, hätte das Gehirn mit 1.080 ml eine Volumenentlastung von 14 ml erfahren, die zu einer ICP-Senkung von 28 mmHg hätte führen sollen. Tatsächlich gemessen wurden nur 20 mmHg ICP-Senkung [18], eine akzeptable Übereinstimmung. So auch eine Vorhersage von 15 mmHg ICP-Abnahme im Vergleich zu einem Messwert von 9,6 mmHg [25]. Unter Berechnungen (s. u.) werden andere Beispiele aufgeführt, bei denen keine akzeptable Übereinstimmung vorliegt.
Literaturübersicht
Vorbemerkungen
Nur mit Einschränkung werden solche Literaturstellen besprochen, die eine offensichtliche „Verwirrung“ zwischen den Begriffen Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) und ihren entsprechenden Zahlenwerten aufweisen [6, 7, 13, 17, 22, 27]. Diese werden im Kapitel Osmolarität und Osmolalität kommentiert.
Weil diese Form der Therapie bereits für nicht zielführend eingestuft wurde (s.o.), werden einige Literaturstellen aufgeführt aber nicht besprochen, sofern sie über eine kontinuierliche Therapie mit hypertoner NaCl-Lösung berichten [12, 15, 16, 21, 26], fast immer bei Kindern [15, 21, 26]. Dies gilt erst Recht für das Therapieziel, eine Hypernatriämie zur Prävention eines Hirnödems einzustellen [28].
Von den einsetzbaren Substanzen Mannit, Sorbit, Glycerin und NaCl-Lösung (7,5% / 10%) haben sich Mannitol und hyperosmolale NaCl-Lösungen durchgesetzt. Beide Therapien sollten oberhalb eines Serum-Natriums von 155 mmol/l oder einer Osmolalität von 320 mosmol/kg H2O streng indiziert werden, auch als kritischer Level bezeichnet [8, 16]. Eine übliche Dosierung beträgt: NaCl 7,5% i. v. Bolus 3 ml/kg KG, bis zu 250 ml/Tag [7]. Die höchsten eingesetzten NaCl-Konzentrationen betragen 23,4 % [23] bzw. 30 % [25].
Bei der traumatischen Hirnverletzung werden 40 ml von 14,6 % NaCl als sicher und hoch effektiv bezeichnet, auch wenn nur 4 von 11 Patienten überlebten [11].
Soll die Wirkung von 15 % NaCl mit 20 % Mannitol verglichen werden [20], dann muss über die Dosierung, hier 2 ml / kg KG (Mannit) bzw. 0,42 ml / kg KG (NaCl), ein Ausgleich vorgenommen werden, damit die osmotische Gesamtzufuhr beider Substanzen für einen Patienten mit 15 l ECFV (75 kg KG) weitgehend ausgeglichen wird (s. u. Berechnungen). Diese erzeugen im ECFV des Patienten eine Osmolalität von 297,5 mosmol/kg H2O (Mannit) bzw. 297,7 mosmol/kg H2O (NaCl), also, wie gewünscht, die gleiche Hyperosmolalität.
Die von den Autoren gemessene ICP-Abnahme betrug in beiden Fällen tatsächlich 8,7 mmHg [20].
Von mehreren Autoren wird ein Grenzwert der gemessenen Osmolalität von 320 mosmol/kg H2O angegebenen, der nicht überschritten werden sollte. Hierbei handelt es sich um den Wert für die extra- und intracelluläre Osmolalität nach (!) abgeschlossenem schnellen Ausgleich durch Wasserdiffusion von innen nach außen. Dieser Wert entspricht einer Gabe von 200 ml einer 23,4 %igen NaCl-Lösung entsprechend 7.696 mosmol/kg H2O. Die entsprechende Wasserverschiebung ergibt 3 l, d.h. das ECFV hat um 3 l zugenommen. Nach Infusion plus Wasserverschiebung ergibt dies eine Natrium-Konzentration von 161 mmol/l eine Chlorid-Konzentration von 129 mmol/l (Berechnungen s. Anhang), Werte die mit den Autoren-Angaben (s. o.) sehr gut vergleichbar sind.
Die sehr zurückhaltende Bewertung der hypertonen NaCl-Lösung zur ICP-Senkung wird mit einigen Zitaten aus Reviews bzw. Metaanalysen belegt:
“The optimal concentration, dose, and mode of administration (bolus vs. continuous infusion) for hypertonic saline are unknown.” [22]
Eine Übersicht und Meta-Analyse nur die 23,4 %ige Lösung betreffend prüft 11 Studien, von denen 6 eine Reduktion des ICP zu 60 % nachweisen konnten [24].
Hypertone Salzlösung scheint dem Mannitol überlegen zu sein [14].
Eine australische Metaanalyse kommt zu dem Schluss, dass der Einsatz hyperosmolarer NaCl-Lösungen bei Patienten mit Schädel-Hirn-Trauma „… may be considered a therapeutic adjunct…“ [30].
“… the clinician must weigh the value of long standing clinical acceptance and safety (mannitol) against a newer, potentially more effective therapy with a limited clinical record (hypertonic saline).” [23].
Ein Ausblick könnte eher lauten: “Thus, maintenance of normal plasma osmolality appears to be a key physiologic aim in the management of patients suffering from traumatic brain injury … “ [29].
Die Deutsche Gesellschaft für Neurologie kann folglich in der aktuellen Leitlinie (2012) keine generelle Empfehlung aussprechen [6].
Nebenwirkungen
In einem Beitrag aus dem Jahre 2013 zum Thema Hirndruck und Hirnödem werden die Nebenwirkungen des Einsatzes hypertoner Lösungen wie folgt zusammengefasst: Hypervolämie, Lungenödem, akutes Nierenversagen und hyperchlorämische metabolische Azidose.“ [7]. Wählt man als Beispiel den Einsatz von 250 ml 10%iger NaCl sind folgende Einwände angebracht:
- Mit 1,85 l kristalliner Flüssigkeit pro Tag, das Resultat von Infusion plus Volumenverschiebung von intra- nach extracellulär (Bilanz s.o.), dürfte kaum eine Hypervolämie zu erzeugen sein.
- Es ist denkbar, dass eine Hyperchlorämie von 118 statt 103 mmol/l (s. u.) ein Nierenversagen verursacht, ob akut bleibt vorläufig offen.
- Mit 1,85 l kristalliner, bikarbonatfreier Flüssigkeit würde bei einem ECFV von 15 l (75 kg KG) die Bikarbonat-Konzentration von 24 auf 21,4 mmol/l verdünnt (pH 7,345), das Basendefizit beträgt dann 3,7 mmol/l, nicht gerade dramatisch.
Abgesehen von der Hyperchlorämie, ein wichtiges Argument, verläuft das Ganze doch recht harmlos.
Bleibt die Frage, welche Nebenwirkungen in der Literatur erwähnt werden.
Eine akute Nierenfunktionsstörung wird vielfach beschrieben, insbesondere bei Kindern [15] mit einer Rate von 20 % [21], aber auch bei Erwachsenen [13, 23], dem wird von anderen Autoren allerdings widersprochen [11].
Die hypertone Lösung soll primär den nicht betroffenen Teil des Gehirns dehydrieren während der verletzte Teil nicht verändert wird [23], in einer Metaanalyse bestätigt [30].
Fazit ICP
- Der in seiner Form nicht veränderbare Schädel beinhaltet drei inkompressible Flüssigkeitsräume, von denen nur Blut und Liquor, partiell nach außen verschoben werden können.
- Jede noch so kleine Volumenzunahme des Gehirns muss zu einem Anstieg des ICP führen, bedingt durch die Verschiebung von Liquor oder Blut aus dem Schädel hinaus.
- Nur ein akuter osmotischer Gradient zwischen Gehirn (ICFV) und Extracellularraum (ECFV), hervorgerufen durch einen hypertonen Bolus, kann Wasser aus dem ICFV nach außen transportieren, jede kontinuierliche Infusion einer hypertonen Lösung kann dies nicht. Eine kontinuierliche Hypernatriämie zur Prävention eines Hirnödems einzustellen, ist nicht zielführend.
- Erst wenn das im ECFV angekommene Wasservolumen aus dem Schädel hinaus befördert worden ist, d.h. mit dem Plasma als Teil des ECFV, wird der ICP gesenkt.
- Der von mehreren Autoren angegebene Grenzwert der gemessenen Osmolalität von 320 mosmol/kg H2O sollte nicht überschritten werden. Er beinhaltet eine intra- extracelluläre Wasserverschiebung von 3 l beim Patienten von 75 kg KG und erzeugt eine Hypernatriämie von 161 mmol/l und eine Hyperchlorämie von 129 mmol/l.
- Die beim Einsatz von hypertoner NaCl-Lösung obligate Hyperchlorämie dürfte für die zahlreichen Berichte über Nierenfunktionsstörungen verantwortlich sein.
- Bei vielen Literaturstellen besteht eine offensichtliche „Verwirrung“ zwischen den Begriffen Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) und ihren entsprechenden Zahlenwerten.
- Die in zahlreichen Reviews und Metaanalysen publizierte sehr zurückhaltende Bewertung der hypertonen NaCl-Lösung zur ICP-Senkung wird mit einem Ausblick kommentiert: “Thus, maintenance of normal plasma osmolality appears to be a key physiologic aim in the management of patients suffering from traumatic brain injury … “
Literatur
6. Deutsche Gesellschaft für Neurologie
Leitlinien für Diagnostik und Therapie in der Neurologie
Entwicklungsstufe: S1 (Stand: September 2012)
Intrakranieller Druck (ICP)
7. Dietrich W, Erbguth F
Hirndruck und Hirnödem
Anaesthesist 2013; 62: 757 - 772
8. Ding Y, Duan A, Lu X
The role of serum osmolality monitoring in patients with severe
intracranial lesion
Zhonghua Wai Ke Za Zhi 1996; 34: 224 - 228
9. Diringer MN
New trends in hyperosmolar therapy?
Curr Opin Crit Care 2013; 19: 77 - 82
10. Ertmer C, Van Aken H
Fluid therapy in patients with brain injury: what does physiology tell us?
Crit Care 2014; 18: 119
11. Eskandari R, Filtz MR, Davis GE, Hoesch RE
Effective treatment of refractory intracranial hypertension after
traumatic brain injury with repeated boluses of 14.6% hypertonic saline
J Neurosurg 2013; 119: 338 - 346
12. Froelich M, Ni Q, Wess C, Ougorets I, Härtl R
Continuous hypertonic saline therapy and the occurrence of
complications in neurocritically ill patients
Crit Care Med 2009; 37: 1433 - 1441
13. Grände PO, Romner B
Osmotherapy in brain edema: a questionable therapy
Neurosurg Anesthesiol 2012; 24: 407 - 412
14. Grape S, Ravussin P
PRO: osmotherapy for the treatment of acute intracranial
hypertension
J Neurosurg Anesthesiol 2012; 24: 402 - 406
15. Gonda DD, Meltzer HS, Crawford JR, Hilfiker ML, Shellington DK,
Peterson BM, Levy ML
Complications associated with prolonged hypertonic saline therapy
in children with elevated intracranial pressure
Pediatr Crit Care Med 2013; 14: 610 - 620
16. Hauer EM, Stark D, Staykov D, Steigleder T, Schwab S, Bardutzky J
Early continuous hypertonic saline infusion in patients
with severe cerebrovascular disease
Crit Care Med 2011; 39: 1766 - 1772
17. Himmelseher S
Hypertonic saline solutions for treatment of intracranial hypertension
Curr Opin Anaesthesiol 2007; 20: 414 - 26
18. Hirsch KG, Spock T, Koenig MA, Geocadin RG
Treatment of elevated intracranial pressure with hyperosmolar therapy
in patients with renal failure
Neurocrit Care 2012; 17: 388 - 394
19. Horn P, Münch E, Vajkoczy P, Herrmann P, Quintel M, Schilling L,
Schmiedek P, Schürer L
Hypertonic saline solution for control of elevated intracranial pressure
in patients with exhausted response to mannitol and barbiturates
Neurol Res 1999; 21: 758 - 764
20. Huang XC, Yang LL
Comparison of 20% mannitol and 15% hypertonic saline in doses of
similar osmotic burden for treatment of severe traumatic brain injury
with intracranial hypertension
Nan Fang Yi Ke Da Xue Xue Bao 2014; 34: 723 - 726
21. Khanna S, Davis D, Peterson B, Fisher B, Tung H, O'Quigley J,
Deutsch R
Use of hypertonic saline in the treatment of severe refractory
posttraumatic intracranial hypertension in pediatric traumatic brain injury
Crit Care Med 2000; 28:1144 - 1151
22. Kheirbek T, Pascual JL
Hypertonic saline for the treatment of intracranial hypertension
Curr Neurol Neurosci Rep 2014; 14: 482 - 487
23. Kølsen-Petersen J.
Osmotherapy. In: Sundstrom T et al., editors
Management of severe traumatic brain injury
Berlin: Springer 2012. p. 293 - 302
24. Lazaridis C, Neyens R, Bodle J, DeSantis SM
High-osmolarity saline in neurocritical care: systematic review and
meta-analysis
Crit Care Med 2013; 41: 1353 - 1360
25. Major EH, O'Connor P, Mullan B
Single bolus 30 % hypertonic saline for refractory intracranial
hypertension
Ir J Med Sci 2015; 184: 159 - 165
26. Peterson B, Khanna S, Fisher B, Marshall L
Prolonged hypernatremia controls elevated intracranial pressure
in head-injured pediatric patients
Crit Care Med 2000; 28: 1136 - 1143
27. Ropper AH
Management of raised intracranial pressure and hyperosmolar therapy
Pract Neurol 2014; 14: 152 - 158
28. Ryu JH, Walcott BP, Kahle KT, Sheth SA, Peterson RT, Nahed BV,
Coumans JV, Simard JM
Induced and sustained hypernatremia for the prevention and
treatment of cerebral edema following brain injury
Neurocrit Care 2013; 19: 222 - 231
29. Van Aken HK, Kampmeier TG, Ertmer C, Westphal M
Fluid resuscitation in patients with traumatic brain injury:
what is a SAFE approach?
Curr Opin Anaesthesiol 2012; 25: 563 - 565
30. White H, Cook D, Venkatesh B
The use of hypertonic saline for treating intracranial hypertension
after traumatic brain injury
Anesth Analg 2006; 102: 1836 - 1846
Anhang Berechnungen
Die folgenden Berechnungen gestalten sich insofern relativ einfach, weil die Osmolalitäten (mosmol/kg H2O) und nicht die Osmolaritäten (mosmol/l) in beiden Flüssigkeitsräumen intra- (ICFV) und ectracelluläres Flüssigkeitsvolumen (ECFV) immer gleich sein müssen. Der Normalwert beträgt daher in beiden Kompartimenten, wie auch im Plasma, 288 mosmol/kg H2O.
Volumeneffekt
Werden bei einem Patienten von 75 kg KG mit einem ECFV von 15 l (20 % KG) 250 ml einer 10 %igen NaCl-Lösung infundiert, dann sind dies 0,25 l einer Lösung mit 1.724 mmol/l bzw. einer Osmolarität von 3.448 mosmol/l bzw. einer Osmolalität von 3.289 mosmol/kg H2O (3.448 x 0,926 osmotischer Koeffizient, geteilt durch den Wassergehalt von 0,9707 g/ml bei einer Dichte von 1,0707 g/ml). Die 3.289 mosmol/kg H2O verteilen sich im ECFV und erzeugen dort eine Osmolalität von 337 mosmol/kg H2O (0,25 l x 3.289 mosmol/kg H2O) + (15 l x 288 mosmol/kg H2O) = 15,25 l x 337 mosmol/kg H2O).
Diese extracelluläre Hyperosmolalität führt sofort zu einem Wasser-Ausstrom aus dem ICFV, bis die beiden Osmolalitäten ausgeglichen sind. Dieser Wert liegt bei 288 + 1/3 der Differenz von 49 (16) also bei 304 mosmol/kg H2O. Ein Drittel deshalb, weil das ICFV mit 30 l doppelt so groß ist wie das ECFV mit 15 l. Dazu muss das ECFV somit 1,6 l aufnehmen (Kontrolle: 15 x 336 = 16,6 x 304), das ICFV hat von 30 auf 28,4 l abgenommen (Kontrolle: 30 x 288 = 28,4 x 304).
Also sind im ECFV 0,25 l der zugeführten Lösung + 1,6 l aus dem ICFV = 1,85 l gelandet, davon verbleiben dann 20 % im IVFV, also insgesamt 0,37 l Flüssigkeit.
Die Zahlenwerte für die Gabe von nur 200 ml der gleichen Lösung lauten:
Osmolalität im ECFV nach Infusion 328 mosmol/kg H2O, Osmolalität nach Ausgleich 301 mosmol/kg H2O, verschobenes Volumen 1,3 l, somit Verbleib im ECFV 1,5 l und im IVFV nur 0,3 l Flüssigkeit statt der infundierten 0,2 l.
Eine ähnliche Berechnung wird von Nakayama et al. [3] vorgenommen:
Ein Schaaf von 45 kg KG mit einem ECFV von 9 l (20 %) und einem ICFV von 18 l (40 %) erhält im Mittel 162 ml einer Lösung von 2.400 mosmol/l entsprechend 2.289 mosmol/kg H2O (Umrechnung s.o.). Das durch osmotische Diffusion von innen nach außen verschobene Volumen soll nach den Autoren 200 ml betragen (162 + 200 ml).
Kontrolle: 0,162 ml mit 2.289 mosmol/kg H2O erzeugen im ECFV eine Osmolalität von 323 mosmol/kg H2O, die nach Ausgleich (288 + 1/3 der Differenz) 300 mosmol/kg H2O erzeugen.
Damit muss das ECFV von 9 auf 9,69 l zunehmen (9 x 323 / 300), d.h. es wurden 690 ml osmotisch verschoben (bei den Autoren 710 ml). Das Gesamtvolumen von 852 ml verteilt sich dann mit 20 % in das IVFV also 170 ml, bei den Autoren zu 50 %, also 426 ml.
Die Expansion des Plasmavolumens beträgt gemäß eigener Rechnung damit 170 ml, nach den genannten Autoren 300 ml, wegen deren Verteilung zwischen ECFV und IVFV.
Es ist daher vollkommen unrealistisch, von einer intravasalen Volumentherapie zu sprechen.
Vorhersage ICP-Senkung
Bei der Vorhersage der ICP-Senkung unter Verwendung der Compliance des ZNS von 0,5 ml/mmHg wird die gleiche Berechnung der Osmolalität vor und nach Wasserdiffusion vorgenommen, danach allerdings wird der Betrag der Wasserdiffusion vom gesamten ECFV auf das Volumen des Gehirns von 1.080 ml bezogen. Dieser Betrag in ml wird dann in eine Druckänderung in mmHg umgerechnet und mit dem von den Autoren gemessenen Wert vergleichen.
- Gabe von 40 ml, 14,6 % NaCl mit 4.802 mosmol/kg H2O [11]:
Osmolalität vor dem Ausgleich 300 mosmol/kg H2O, danach 292 mosmol/kg H2O.
Zunahme ECFV bzw. Abnahme des ICFV 0,41 l entsprechend 1,37 %.
Somit hätte des Gehirn (1.080 ml) um 14,8 ml abgenommen, also sollte die ICP-Abnahme 29,5 mmHg betragen, gemessen wurden aber nur 12 mmHg (40 auf 28 mmHg). - Gabe von 45 ml, 23,4 % NaCl mit 7.696 mosmol/kg H2O [18]:
Osmolalität vor dem Ausgleich 311 mosmol/kg H2O, danach 296 mosmol/kg H2O.
Zunahme ECFV bzw. Abnahme des ICFV 0,4 l entsprechend 1,33 %.
Somit hätte des Gehirn (1.080 ml) um 14 ml abgenommen, also sollte die ICP-Abnahme 28 mmHg betragen, gemessen wurden aber nur 20 mmHg. - Gabe von 150 ml, 15 % NaCl mit 4.934 mosmol/kg H2O [19]:
Osmolalität vor dem Ausgleich 334 mosmol/kg H2O, danach 303,3 mosmol/kg H2O.
Zunahme ECFV bzw. Abnahme des ICFV 1,52 l entsprechend 5,07 %.
Somit hätte des Gehirn (1.080 ml) um 54,7 ml abgenommen, also sollte die ICP-Abnahme 109 mmHg betragen, gemessen wurden aber nur 15 mmHg (33 auf 18 mmHg). - Gabe von 0,42 ml/kg KG (0,0315 l), 15 % NaCl mit 4.934 mosmol/kg H2O oder
2 ml/kg KG (0,15 l), 20 % Mannitol mit 1.248 mosmol/kg H2O [20]:
NaCl: Osmolalität vor dem Ausgleich 297,7 mosmol/kg H2O, danach 291,2 mosmol/kg H2O.
Zunahme ECFV bzw. Abnahme des ICFV 0,33 l entsprechend 1,1 %.
Somit hätte des Gehirn (1.080 ml) um 12 ml abgenommen, also sollte die ICP-Abnahme 24 mmHg betragen, gemessen wurden aber nur 8,7 mmHg.
Mannitol: Osmolalität vor dem Ausgleich 297,5 mosmol/kg H2O, danach 291,2 mosmol/kg H2O. Zunahme ECFV bzw. Abnahme des ICFV 0,33 l entsprechend 1,1 %.
Somit hätte des Gehirn (1.080 ml) um 12 ml abgenommen, also sollte die ICP-Abnahme 24 mmHg betragen, gemessen wurden aber nur 8,7 mmHg. - Gabe von 10 ml, 30 % NaCl mit 10.519 mosmol/kg H2O [25]:
Osmolalität vor dem Ausgleich 294,8 mosmol/kg H2O, danach 290,3 mosmol/kg H2O.
Zunahme ECFV bzw. Abnahme des ICFV 0,24 l entsprechend 0,8 %.
Somit hätte des Gehirn (1.080 ml) um 7,4 ml abgenommen, also sollte die ICP-Abnahme 15 mmHg betragen, gemessen wurden aber nur 9,6 mmHg (28 auf 18,44 mmHg).
Die Übereinstimmung zwischen Vorhersage und Messung der ICP-Abnahme ist schlecht, Ursache dafür dürfte die Angabe für die Compliance mit ca. 0,5 ml/mmHg sein.
Grenzwerte von Osmolalität, Natrium- und Chlorid-Konzentration
Wiederholt wird ein Grenzwert der gemessenen Osmolalität von 320 mosmol/kg H2O. angegebenen, d.h. der Wert für die extra- und intracelluläre Osmolalität nach schnellem Ausgleich durch Wasserdiffusion.
Berechnung der Werte für die Gabe von 200 ml einer 23,4 %igen NaCl-Lösung entsprechend 7.696 mosmol/kg H2O:
(0,2 l x 7.696 mosmol/kg H2O) + (15 l x 288 mosmol/kg H2O) = 15,2 l x 385 mosmol/kg H2O
Addition von 1/3 der Differenz von 97,5 = 32,5 zum Normalwert 288 = 320,5 mosmol/kg H2O.
Mit 200 ml einer 23,4 %igen NaCl-Lösung wird nach Ausgleich eine Osmolalität von 320,5 mosmol/kg H2O erreicht.
Die entsprechende Wasserverschiebung ergibt 3 l, d.h. das ECFV hat um 3 l zugenommen, das ICFV um 3 l abgenommen.
Resultierende Grenzwerte für Natrium und Chlorid (0,9 %NaCl = 154 mmol/l somit 23,4 % = 4.000 mmol/l Natrium bzw. Chlorid).
Der Grenzwert der Natrium-Konzentration ergibt 161 mmol/l:
- Infusion: (0,2 x 4.000) + (15 x 142) = 15,2 x 193 mmol/l Natrium
- Verdünnung: 193 x 15,2 / 18,2 = 161 mmol/l Natrium
Die Grenzwert der Chlorid-Konzentration ergibt 129 mmol/l:
- Infusion: (0,2 x 4.000) + (15 x 103) = 15,2 x 154 mmol/l Chlorid
- Verdünnung: 154 x 15,2 / 18,2 = 129 mmol/l Chlorid
Hyperchlorämie
Die entstandene Hyperchlorämie ist praktisch immer massiv, die Folgen sind unter Hyperchlorämie beschrieben.
Folgende Beispiele werden, wie im Text erwähnt, genannt:
- 250 ml einer 10 %igen NaCl-Lösung mit 1.724 mmol/l Chlorid:
(0,25 l x 1.724 mmol/l) + (15 l x 103 mmol/l) = 15,25 l x 130 mmol/l Chlorid.
Nach Diffusion von 1,6 l Wasser: 130 x 15,25 / 16,85 = 118 mmol/l Chlorid. - 200 ml der gleichen Lösung:
(0,2 l x 1.724 mmol/l) + (15 l x 103 mmol/l) = 15,2 l x 124 mmol/l Chlorid.
Nach Diffusion von 1,3 l Wasser: 124 x 15,2 / 16,5 = 114 mmol/l Chlorid. - 200 ml einer 23,4 %igen NaCl-Lösung mit 4.000 mmol/l Chlorid:
Nach Infusion: (0,2 l x 4.000 mmol/l) + (15 l x 103 mmol/l) = 15,2 x 154 mmol/l Chlorid.
Nach Wasserdiffusion von 3 l nach außen: 154 x 15,2 / 18,2 = 129 mmol/l Chlorid.
Cave Hyperchlorämie (Hyperchloridämie)
Der Einsatz hyperchlorämer Infusionslösungen sollte unterbleiben, weil die Hyperchlorämie die Nierenfunktion negativ beeinflusst, wie die folgende Zusammenstellung zeigt.

Details zur Problematik der Hyperchlorämie sind hier nachzulesen. Dort findet sich auch die angegebene Literatur.
Osmolalität versus Osmolarität
Bereits in einer neueren Arbeit zum Thema wurde darauf hingewiesen, dass sich in der Literatur zahlreiche Beispiele dafür finden, dass die beiden Begriffe Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) verwechselt werden, dies betrifft allein 4 von 36 Publikationen zum Thema [Fazekas et al. 2013].
Eine ausführliche Darstellung der Problematik findet sich am Beispiel des Normalwertes der Plasma-Osmolalität.
Auch in einigen der hier zitierten Arbeiten wird diese „Verwirrung“ perpetuiert, dies betrifft erneut die Begriffe Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) und ihre entsprechenden Zahlenwerte [6, 7, 13, 17, 22, 27], wie folgende Beispiele belegen.In der Leitlinie der Deutschen Gesellschaft für Neurologie wird eine maximale Osmolalität von 340 mosmol/l definiert [6].
In Tab. 1 einer Übersicht [17] werden die theoretischen Osmolalitäten genannt, die Zahlenwerte entsprechen aber den Osmolaritäten, allerdings mit der richtigen Einheit (NaCl 308 mosmol/kg H2O); 20 % Mannit wird dort mit 1.248 mosmol/kg H2O angegeben, hier mit 1.100 mosmol/kg H2O.
In Tab. 1 einer anderen Übersicht [27] werden die Osmolaritäten in mosmol/l angegeben, die Zahlenwerte entsprechen aber eher den Osmolalitäten.
In der gleichen Arbeit [27] findet sich die falsche Aussage „In den meisten Laboren wird die Osmolalität gemessen, die Werte entsprechen aber denen der Osmolarität.“
Richtig ist, dass man als Alternative zur Messung der Osmolalität im Zentrallabor die präzise Berechnung per Hand oder durch ein „modernes“ BGA-Gerät wählen kann, sofern die entsprechenden Messwerte vorliegen.
Generelles Fazit
- Nach einem akuten Verlust bis ca. 20 % des Blutvolumens werden infolge Sympathicus-Aktivierung maximal 150 ml interstitieller, proteinfreier Flüssigkeit zur Restitution des Plasmavolumens ersetzt.
- Kommt es zum Volumenmangel-Schock, wirkt die dabei auftretende Hyperosmolalität über den Normalwert des Plasmawertes von 288 mosmol/kg H2O hinaus als treibende Kraft für die Restitution des Plasmavolumens.
- Die Hyperosmolalität im Schock sorgt innerhalb weniger Minuten für eine Wasserdiffusion aus dem intracelluären (ICFV) in den extracellulären (ECFV) Raum bis zum Ausgleich beider Osmolalitäten.
- Jede im Plasma gemessene Hyperosmolalität beschreibt einen Zustand nach (!) erfolgtem Wasserausgleich.
- Neben der Glukose (Hyperglykämie) werden für die Hyperosmolalität auch unbekannte Substanzen, „unmeasured anions“ (UMA), verantwortlich gemacht, die beim Vergleich von gemessener und berechneter Osmolalität als osmolale Lücke (OL) erscheinen.
- Handelt es sich bei den UMA um unbekannte Säure-Anionen, dann wird der Base Excess (BE, mmol/l) messbar um einen Betrag erhöht, der über der ansonsten proportionalen Laktat-Konzentration des Plasmas liegt.
- UMA im Plasma können daher als Osmolalität gemessen > berechnet (OL) oder als BE > cLaktat (ΔBE) erfasst werden.
- Die Hyperosmolalität wird auch bei schwer verletzten Patienten ohne Blutverlust beobachtet, die bei Überlebenden reversibel und bei Verstorbenen irreversibel ist.
- Die Hyperosmolalität und die konsekutiv erhöhte OL stellt einen wichtigen Prognose-Indikator dar, ein Grenzwert der OL von über 40 mosmol/kg H2O soll letal sein.
- Wie die Laktat-Clearance auch kann die Rückbildung der OL als günstiger Prognose-Indikator interpretiert werden.
- Es wird bezweifelt, dass die Hyperosmolalität ein effektiver „Notfall-Mechanismus des Organismus“ ist, einen Blutverlust zu kompensieren.
- Bei akutem, nicht chronischem, vital bedrohlichen Volumenmangel ist eine einmalige Gabe einer hyperonkotischen Infusionslösung geeignet, die schnellstmögliche Wiederauffüllung des intravasalen Flüssigkeitsvolumens (IVFV) unter Einbeziehung von Flüssigkeitsreserven des Interstitiums (ECFV) zu erzielen.
- Für den hämorrhagischen Schock beim Menschen fehlt der Nachweis, dass die Mortalität nach Einsatz von hypertoner NaCl-Lösung im Sinne der small volume resuscitation gesenkt würde, auch wenn ein signifikanter Anstieg des Blutdrucks belegt werden kann.
- Ein intravasaler Volumeneffekt im Sinne einer small volume resuscitation wird bei der Reanimation ausgeschlossen.
- Auch die resultierende Hyperchlorämie mit ihrer negativen Wirkung auf die Nierenfunktion spricht gegen den Einsatz hypertoner NaCl-Lösungen.
- Sollen hypertone NaCl-Lösungen zur Therapie der intrakraniellen Hypertension (ICP) verwendet werden, kann nur ein Bolus einen osmotischen Gradienten aufbauen.
- Bei kontinuierlicher Infusion einer hypertonen NaCl-Lösung stellt sich kein osmotischer Gradient ein, so dass diese Therapie keinen Sinn ergibt.
- Erst wenn das im ECFV angekommene Wasservolumen aus dem Schädel hinaus befördert worden ist, d.h. mit dem Plasma als Teil des ECFV, wird der ICP gesenkt.
- Der Grenzwert der gemessenen Osmolalität von 320 mosmol/kg H2O sollte nicht überschritten werden. Er beinhaltet eine von intra- nach extracellulär erfolgte Wasserverschiebung von 3 l beim Patienten von 75 kg KG und erzeugt eine Hypernatriämie von 161 mmol/l und eine Hyperchlorämie von 129 mmol/l.
- Die beim Einsatz von hypertoner NaCl-Lösung obligate Hyperchlorämie dürfte für die zahlreichen Berichte über Nierenfunktionsstörungen verantwortlich sein.
- Die in zahlreichen Reviews und Metaanalysen geäußerte sehr kritische Bewertung der hypertonen NaCl-Lösung zur ICP-Senkung wird mit einem Zitat aus einer dieser Arbeiten zusammengefasst: Maintenance of normal plasma osmolality appears to be a key physiologic aim.
- Die Begriffe Osmolarität (mosmol/l) und Osmolalität (mosmol/kg H2O) und ihre entsprechenden Zahlenwerte, von vielen Autoren verwechselt, sind zu differenzieren.
