
Qualität von FFP
Fragestellung
Wegen ihrer hypernatriämischen, hypochlorämischen, hyperglykämischen, hyperphosphatämischen und hyperosmolalen Eigenschaften wurden CPD-Präparate von FFP (fresh frozen plasma, GFP, Gefrierplasma) bisher als potentieller Volumenersatz (volume expander) verworfen [3, 5]. Um diese Festlegungen zu überprüfen, wurden entsprechende Präparate je nach Herstellungsverfahren genauer untersucht, also FFP aus der Einzel-Blutspende, aus Pool-Plasma oder aus der maschinellen Apherese. Dazu wurden Voraussagen gemacht und diese mit exemplarisch übermittelten externen Messwerten verglichen. Details zu den Vorhersagen finden sich im Anhang I, Angaben zu einzelnen Zahlen- und Rechenwerten im Anhang II.
Messwerte
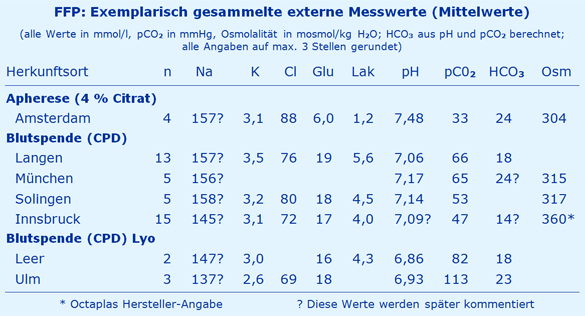
In der folgenden Tabelle sind extern gewonnene Messwerte zusammengestellt.
Vorhersagen und Kommentare
Es wird versucht, die Zusammensetzung des FFP aus den Einzel-Daten der Komponenten vorherzusagen. Dies erfolgt für die Plasma-Spende aus einer typischen Blutspende, wobei in einem Blutbeutel 63 ml CPD-Lösung mit 450 ml Blut bzw. 248 ml Plasma (Hct 45 %) gemischt werden [11]. Die Verdünnung des Plasmas beträgt dann 1,25 bzw. 25 % (311 : 248). Aktuell werden auch andere Blutbeutel eingesetzt, bei denen z. B. 70 ml CPD-Lösung mit 500 ml Blut (= 275 ml Plasma) gemischt werden, also 70 ml + 275 ml, d.h. die gleiche Verdünnung von 1,25 bzw. 25 % (345 : 275).
Für das Apherese-Präparat wird unter Verwendung von 4 % Natrium-Citrat eine Verdünnung von Antikoagulanz zu Blut (AC : Blut) von 1 : 16 angenommen, wobei unter dieser Angabe immer 1 plus 16 verstanden wird. Bezogen auf das Plasma (Hct 45 %) sind das dann z. B. 10 ml Lösung + 160 ml Blut (1 + 16) bzw. 88 ml Plasma. Damit beträgt die Verdünnung des Plasmas bei Verwendung von 4 % Citrat 1,11 bzw. 11 % (98 : 88 = 1,11).
Die genauen Zusammensetzungen von 4 % Citrat, CPD und ACD finden sich im Anhang II. Es sei darauf hingewiesen, dass CPD und ACD beide die „unnötige“ Glukose enthalten, unnötig, weil sie ursprünglich für die Erythrozyten-Lagerung des Vollbluts erforderlich war, im FFP aber keinen Sinn mehr ergibt. Das gleiche gilt für das Phosphat der CPD-Lösung.
Im Folgenden werden die einzelnen Substanzen des FFP besprochen.
Clorid
Mit Chlorid als klassischem Indikator des Extrazellularraumes sollte über die gemessene Chlorid-Konzentration des Plasmas die Verdünnung des Plasmas erfasst werden, weil alle verwendeten herkömmlichen Lösungen chloridfrei sind. Diese Aussage gilt mit Einschränkung auch für das Kalium.
- Plasma aus der Blutspende
Die Plasma-Verdünnung, also 63 ml + 248 ml Plasma = 311 ml FFP, sollte 25 % bzw. 1,25 betragen. Somit würde man eine Chlorid-Konzentration von 82,4 mmol/l erwarten (103 : 1,25). Diese wird mit den hier verwendeten ISE-Elektroden deutlich unterschätzt (s. Anhang I), wie die Messwerte (Langen) mit 76,4 mmol/l belegen. - Plasma aus der Apherese
Der Messwert (Amsterdam) von 87,8 mmol/l liegt unter dem erwarteten Wert, jetzt um ca. 5 %. Hier gilt das gleiche Argument, d.h. die Chlorid-Elektrode unterschätzt den wahren Wert.
Natrium
- Plasma aus der Blutspende
Bei der Mischung von 63 ml CPD mit 248 ml Plasma zu 311 ml FFP ist eine Natrium-Konzentration von 170,8 mmol/l zu erwarten (s. Anhang I). Dieser hohe Natrium-Wert wird bei der Messung (Langen, München) mit 156 mmol/l um knapp 10 % deutlich unterschritten. Als Ursache kommt wieder die Problematik der Natrium-Messung mit einer ISE-Technologie in Frage (s. Anhang I). - Plasma aus der Apherese
Wie im Anhang I beschrieben wäre in diesem Falle bei einer Verdünnung von 11 % eine Natrium-Konzentration von 169,1 mmol/l zu erwarten, also praktisch der gleiche Wert wie beim Plasma aus der Blutspende. Auch hier liegt der gemessene Wert (Amsterdam) mit 157,3 mmol/l wieder um einen ähnlichen Betrag darunter, nämlich hier um 7,5 %. Also kann wieder die gleiche Argumentation angeführt werden, Unterschätzung im Beisein von Citrat.
Laktat
- Plasma aus einer Blutspende
Die Laktat-Konzentration im Blut (EK) steigt bei Raumtemperatur pro Tag um 6,5 mmol/l Blut an [8]. Wegen der ungleichen Verteilung des Laktats zwischen Erythrozyten und Plasma (die Erys enthalten nur 43 % des Plasmawertes) ergibt dies für den Plasmawert 8,7 mmol/l pro Tag) bzw. 0,36 mmol/l pro Stunde. Mit diesem Wert kann man aus dem Laktat-Anstieg auf die Zeit schließen, die zwischen Blutabnahme und Zentrifugation vergangen ist. Beispiel: Ein mittlerer Anstieg der Laktat-Konzentration um 4,1 mmol/l, nämlich 5,6 mmol/l Messwert abzüglich 1,5 mmol/l Normalwert (Langen) bedeutet, dass ca. 11 Stunden zwischen Blutabnahme und Zentrifugation (Plasma-Trennung von den Erys) vergangen sein dürften.
Die erste Konsequenz: Die Milchsäure-Bildung führt dazu, dass die Plasma-Bikarbonat-Konzentration in dieser Zeit abgenommen haben muss.
Die zweite Konsequenz: Die H+-Ionen der Milchsäure werden zum Teil von den Erythrozyten gepuffert und erzeugen ein saures EK. Das verbleibende Laktat im FFP alkalisiert und muss bei der Berechnung des BEpot addiert werden (s. u.). - Plasma aus der Apherese
In diesem Falle wird nur die normale Laktat-Konzentration des Spenders erfasst, am Beispiel Amsterdam 1,2 mmol/l.
Werte von pH und pCO2
Diese Werte haben als Einzelwerte keine große Relevanz, sie schwanken sehr von Präparat zu Präparat infolge Verlust von CO2. In jedem Falle aber kann daraus die Bikarbonat-Konzentration verlässlich berechnet werden, weil eine Änderung des pCO2 zwar den pH-Wert, nicht aber die HCO3-Konzentration ändert. Diese Aussage basiert auf der Tatsache, dass durch die Plasma-Proteine nur eine minimale Pufferung erfolgt.
- Plasma aus der Blutspende
Bei der Blutspende entstehen infolge des Zusatzes von Citronensäure hohe pCO2- und folglich niedrige pH-Werte (s. Tabelle Messwerte), die dann, je nach Lagerung und Handhabung (CO2-Verlust), zusätzlich unterschiedlich ausfallen können. - Plasma aus der Apherese
Hier wird ohne Citronensäure gearbeitet, daher treten fast normale Werte für pH und pCO2 auf, die nur durch den Apherese-Prozess mit CO2-Verlust und Verdünnung des Plasmas verursacht werden.
HCO3
Bei der Vorhersage der HCO3-Konzenration sind die Faktoren Plasma-Verdünnung sowie die Zugabe von Säuren zu berücksichtigen.
- Plasma aus der Blutspende
Dem Blut wird durch die Zugabe von Citronen- und Phosphorsäure ein BE von -9,7 mmol/l aufgezwungen (s. Anhang I). Die HCO3-Konzentration muss folglich abnehmen.
Die atypisch normale HCO3-Konzentration bei den Präparaten aus München konnte nicht geklärt werden. - Plasma aus der Apherese
Hier wird ohne Citronensäure (und Milchsäure) gearbeitet, wenn es zu einer Änderung der HCO3-Konzentration kommen sollte, dann nur aufgrund der Plasma-Verdünnung von 11 %.
Die zu erwartende HCO3-Konzentration dürfte daher bei 21,6 mmol/l liegen, die gewonnenen Messwerte liegen allerdings darüber beim Normalwert von 24 mmol/l (Amsterdam).
Citrat und BEpot
Da sich das Citrat ausschließlich im Plasma wiederfindet, kann mit der jeweiligen Verdünnung 25 bzw. 11 % die Citrat-Konzentration berechnet werden. Somit kann mit Hilfe dieser Berechnung der potentielle Base Excess BEpot (mmol/l) ermittelt werden. Da Citrat mit einer Halbwertszeit von 36 min [7] relativ schnell metabolisiert wird, muss mit dieser Alkalisierung innerhalb von ca. 1 Stunde gerechnet werden.
- Plasma aus der Blutspende
Für das klassische Blutbeutel-System ergibt sich eine Citrat-Konzentration von 21,3 mmol/l und damit einen metabolisch bedingten BE von +64 mmol/l. Zusammen mit dem BE des Plasmas von ca. -10 mmol und dem im Plasma vorhandenen, ebenfalls alkalisierenden Laktat von ca. 6 mmol/l ergibt sich ein BEpot von +60 mmol/l. - Plasma aus der Apherese
Die Plasma-Verdünnung beträgt hier nur 1,11, d.h. im FFP erscheinen nur ca. 14 mmol/l Citrat, die mit 14,2 mmol/l auch gemessen wurden [1]. Dieses Citrat bewirkt einen metabolischen BE von +42 mmol/l, zusammen mit dem Blut BE von angenähert 0 mmol/l und dem fehlenden Laktat ergibt dies einen BEpot von +42 mmol/l.
Glukose
Die von außen mit CPD zugeführte (überflüssige) Glukose erzeugt kein osmotisches Ungleichgewicht, weil die Glukose ungehindert in die Erythrozyten diffundiert. Da die CPD-Lösung, das Plasma und die Erythrozyten sehr unterschiedliche Wasser-Konzentrationen aufweisen, ist die Gleichgewichts-Konzentration gegeben, wenn die Konzentration in allen drei Räumen, bezogen auf die Wasserräume, gleich ist (s. Anlage I). Die Bilanz muss daher mit der Angabe mmol/kg H2O ermittelt werden (s. Anhang II) unter Verwendung der Wasser-Konzentrationen von CPD, Plasma und Erythrozyten.
- Plasma aus der Blutspende
Die Bilanz ergibt eine Glukose-Konzentration von 19,7 mmol/l. Die sehr gute Übereinstimmung mit dem Messwert von 19,2 mmol/l (Langen) spricht für die Bilanzierung unter Verwendung der Volumina und der Glukose-Konzentrationen. Bei der Messung der Osmolalität des FFP ist somit eine glukosebedingte Erhöhung gegenüber dem Normalwert zu erwarten, die aber keine Bedeutung hat, weil sie osmotisch nicht wirksam wird. - Plasma aus der Apherese
In diesem Fall wird die normale Plasma-Glukose-Konzentration des Spenders in das gewonnene Plasma übernommen, wie am Beispiel Amsterdam zu sehen ist.
Osmolalität
Glukose und Citrat werden beide bei der Messung der Osmolalität im FFP erfasst. Die Glukose übt infolge des Austausches mit den Erythrozyten und später mit den Körperzellen des Empfängers keinen osmotischen Effekt aus. Citrat hingegen gelangt nur ins Plasma und kann nur dort die Osmolalität erhöhen, die in Folge eines Wasseraustausches mit den Erythrozyten mit deren Osmolalität ausgeglichen werden muss (s. Anhang I).
- Plasma aus der Blutspende
Da die CPD-Lösung ohne Glukose mit 5 % nur leicht hyperton ist, wird die Osmolalität des FFP nur wenig erhöht. Der Messwert von 315 - 317 mosmol/kg H2O (Solingen, München) ist realistisch, weil zu den vorhergesagten 290 mosmol/kg H2O (s. Anhang I) noch 16 mosmol/kg H2O für die Glukose zu addieren sind, die messtechnisch erfasst werden (also 306). Also ergibt dies eine recht gute Übereinstimmung zwischen der Glukose-korrigierten Vorhersage (306 mosmol/kg H2O) und dem Messwert (315 - 317 mosmol/kg H2O). - Plasma aus der Apherese
Der Messwert von 304 mosmol/kg H2O (Amsterdam) kommt zustande, weil die Osmolalität der 4%igen Citrat-Lösung mit 370 mosmol/kg H2O relativ hoch ist. Die Vorhersage ergibt eine Plasma-Osmolalität von 296 mosmol/kg H2O, die sofort osmotisch ausgeglichen werden muss. Die gemeinsame Osmolalität von Erythrozyten und Plasma würde dann nach Austausch von Wasser 293 mosmol/kg H2O betragen, eine recht gute Übereinstimmung mit dem Messwert (Amsterdam) von 304 mosmol/kg H2O. Die Konsequenz aber wäre, dass unter der Apherese um ca. 5 % geschrumpfte Erythrozyten an den Spender abgegeben werden müssten (s. Anlage I), legt man die gemessenen Daten aus Amsterdam zugrunde.
In vivo-Osmolalität
Unter der in vivo-Osmolalität wird verstanden, dass aus 1 Mol Citrat vornehmlich im Metabolismus der Leber 3 Osmol HCO3 entstehen. Damit wird das Blutspende-FFP in vivo nach erfolgter Metabolisierung deutlich hyperosmolal, abgesehen vom CitrISO-FFP mit 317 mosmol/kg H2O wären das dann 344 bzw. 350 mosmol/kg H2O (s. Tabelle 2).
Alternativen
Octaplas
Bei den Innsbruck-Daten handelt es sich um Octaplas (Octapharma Pharmazeutika, Wien), ein solvent-detergent (SD) behandeltes standardisiertes gepooltes Human-Plasma, das nach Vireninaktivierung in 200 ml Beuteln eingefroren wird.
Die Vireninaktivierung wird nach der SD-Methode mit 1% Tri-(N-Butyl)-Phosphat (TNBP) und 1% Triton X-100 durchgeführt. Diese SD-Reagenzien werden im Reinigungsprozess entfernt. Die maximale Menge TNBP und Triton X-100 im Fertigprodukt beträgt 2 μg/ml bzw. 5 μg/ml (Fachinformation).
Die Daten aus Innsbruck (Octaplas) zeigen eine erstaunlich geringe Streuung (nicht dargestellt) und erfordern einige Spekulationen. Die Werte dürften weitgehend typisch sein für ein Blutspende-Präparat, einschließlich Glukose und Phosphat, die eigentlich nicht ins FFP gehören (s. o.). Nicht typisch dürfte die angegebene Osmolalität von 360 mosmol/kg H2O sein [6], weil sie deutlich höher als bei den anderen Präparaten ausfällt. Dies wäre nur möglich, wenn das Präparat weitere, nicht genannte Zusätze enthält, vermutlich Substanzen mit sauren Eigenschaften, weil die HCO3-Konzentration mit nur 14 mmol/l atypisch niedrig ausfällt. Hier käme u. a. das saure NaH2PO4 als Kandidat in Frage, weil es mit 5,7 mmol/l [6] um 2,4 mmol/l höher ausfällt, als aus der Verdünnung des CPD-Phosphats (16,1 mmol/l) zu erwarten wäre (3,3 mmol/l). Dafür spricht auch der ziemlich stabile pH von 7,09, der sich allerdings von der Angabe des Herstellers, ohne pCO2-Angabe, mit 7,30 deutlich unterscheidet [6]. Damit wäre Octaplas mit 360 mosmol/kg H2O kräftig hyperton, selbst wenn nach der raschen Metabolisierung der Glukose bis zum Normalwert (5 mmol/l) die Osmolalität dann in vivo nur noch 360 - 11,5 = 348 mosmol/kg H2O betragen würde. Nach der Metabolisierung von Citrat hingegen würde die Osmolalität nochmals kräftig ansteigen, weil im Metabolismus von Citrat pro Mol Citrat 3 Mol HCO3 entstehen. Diese Änderung der Osmolalität wird im Ergebnis als in vivo-Osmolalität (s. Anhang I) bezeichnet.
Bei 22 mmol/l Citrat [6] würde dies abzüglich der ursprünglichen 60 mosmol/kg H2O (22 x 4 x 0,681) für Na3Citrat eine Zunahme von 66 mmol/l NaHCO3 (22 x 3) entsprechend 122 (66 x 2 x 0,926) mosmol/kg H2O ergeben, also eine Erhöhung der Osmolalität um 62 (122 – 60) mosmol/kg H2O auf dann immerhin 410 mosmol/kg H2O (348 + 62). Damit würde Octaplas-FFP mit 410 mosmol/kg H2O noch stärker hyperosmolal.
Ein ungelöstes Problem stellt die auffällig normale Natrium-Konzentration von 145 mmol/l dar (hier gemessen mit einer ISE-Elektrode), weil der Hersteller [6] einen weitgehend plausiblen Wert von 163 mmol/l angibt (gemessen mit validierter Flammenphotometrie), plausibel gemessen an der Vorhersage von 171 mmol/l (s.o.).
Die Firma Octapharma (Wien) wurde – leider ohne Erfolg – um einen Kommentar zu diesen Spekulationen gebeten.
CitrISO-FFP aus der Apherese (Annahme)
Mit einem neuen Citrat-Präparat, sog. CitrISO, kann ein FFP hergestellt werden, das die meisten der problematischen Werte nicht mehr aufweist. Es handelt sich hierbei um ein Arginin-Citrat (Arg3Citrat), das hier ausführlich beschrieben wird.
Für den Fall der Apherese wird die gleiche Verdünnung vorgestellt, also eine fiktive Mischung (s. o.) von 10 ml CitrISO + 88 ml Plasma = 98 ml FFP, so dass CitrISO-FFP 10 % der folgenden Lösung enthält (mmol/l): NaHCO3 24; NaCl 3,4; Arg3Citrat 100; BE ± 0; BEpot ± 0; Osmolalität 288 mosmol/kg H2O.
Kann die Zufuhr von Arginin mit einem CitrISO-FFP limitierend sein?
Die übliche Tagesdosis an Arginin bei einer typischen parenteralen Ernährung beträgt neben anderen Aminosäuren bis zu etwa 75 mmol pro Tag. Diesen Betrag kann man aus den Fachinformationen für Nutriflex Combi (B. Braun Melsungen) oder Aminomix 4 (Fresenius Kabi) ableiten. Für CitrISO-FFP bedeutet dies: 10 mmol/l Arg3Citrat (10 % im FFP) setzen 30 mmol/l Arginin frei, d.h. in einem Liter FFP (4 x 250 ml) befinden sich 30 mmol Arginin und damit enthalten 10 FFP à 250 ml (= 2,5 Liter) die übliche klinische Tagesdosis für Arginin.
Lyoplasma
Von 2007 bis 2011 wurden mehr als 230.000 Einheiten Lyo-Plasma – ohne jegliche Meldungen über klinische Nachteile – vom Deutschen Roten Kreuz West ausgeliefert [2]. Die wenigen Messwerte (Leer, Ulm) zeigen für ein Blutspende-FFP typische Ergebnisse. Auffallend sind allerdings die, gegenüber der Vorhersage, atypisch niedrigen Natrium- und Chlorid-Konzentrationen, für die bisher keine Erklärung vorliegt. Messwerte für die Osmolalität liegen leider nicht vor.
Nachtrag vom 19.12.2014
Der DRK Blutspendedienst West - Zentralbereich Plasma (Hagen) hat freundlicherweise folgende Messwerte aus 2008 zur Verfügung gestellt:
Gemessene Osmolalität 300,6 mosmol/kg H2O (SD ± 3,8; n = 576).
Interpretation
Bei der Messung der Osmolalität des FFP ist eine glukosebedingte Erhöhung gegenüber dem Normalwert von 288 (incl. 5 mosmol/kg H2O für Glukose) von 15 mosmol/kg H2O zu erwarten (s.o.). Für das Lyo-FFP würde dies einen Wert von 303 mosmol/kg H2O ergeben, eine optimale Übereinstimmung mit dem Wert von 300,6 aus Hagen. Gemessen an den anderen Messwerten des FFP aus der Blutspende (s. Tab. 1) von 315 - 317 mosmol/kg H2O wäre dies eine Differenz von knapp -5 %.
Diese Differenz wäre dadurch zu erklären, dass es bei der Herstellung des Lyo-Plasmas zu einem geringfügigen Verdünnungseffekt kommt, da aus 200 ml Plasma über die Restituierung mit 200 ml Aqua dest. 213 ml Lyoplasma entstehen, also eine Verdünnung von 6 %. Diese geringfügige Verdünnung würde die niedrigen Natrium- und Chlorid-Werte erklären.
Zusammenfassung
An dieser Stelle werden die 3 möglichen FFP-Präparate mit ihren typischen Werten miteinander verglichen.
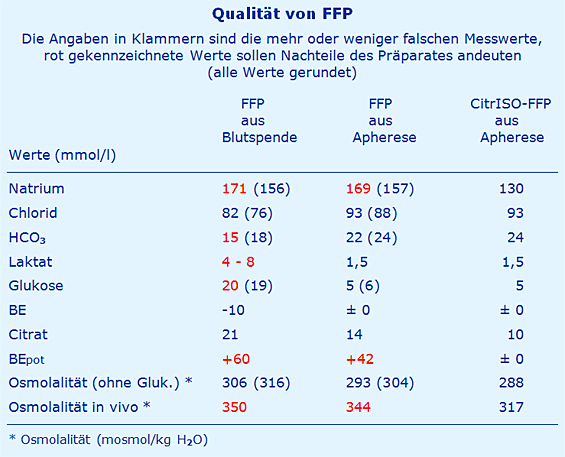
Fazit
- FFP-Präparate aus der Blutspende und der Apherese sind beide stark hypernatriämisch, leicht hypochlorämisch, stark alkalisierend und in vivo – nach Metabolisierung von Citrat – hyperosmolal.
- FFP aus der Blutspende hat die zusätzlichen Nachteile, dass es Glukose und Phosphat enthält, beide werden immer noch mitgeführt, obwohl sie ursprünglich nur für die Erythrozyten-Lagerung gedacht waren.
- FFP aus der Apherese hat deutliche Vorteile gegenüber FFP aus der Blutspende: der Säure-Basen-Status ist quasi physiologisch ohne das überflüssige Laktat.
- FFP aus der Apherese hat den Nachteil, dass unter der Apherese osmotisch um ca. 5 % geschrumpfte Erythrozyten an den Spender abgegeben werden, das FFP selbst ist um ca. 5 % hyperosmolal.
- Praktisch alle erwähnten Nachteile herkömmlicher FFP-Präparationen könnten umgangen werden, wenn bei der Apherese statt Natrium-Citrat ein neues Arginin-Citrat eingesetzt würde (CitrISO).
Anhang I: Vorhersagen der FFP-Zusammensetzung
Clorid
- Plasma aus der Blutspende
Die Plasma-Verdünnung von 25 % sollte eine Chlorid-Konzentration von 82,4 mmol/l erzeugen (103 : 1,25). Dies ist offensichtlich nicht der Fall, die Messwerte (Langen) liegen mit 76,4 mmol/l deutlich darunter. Zu einem Wert von 77 mmol/l, ebenfalls unter Verwendung von 63 ml CPD-Lösung, kommen auch andere Autoren [4]. Auch wenn die Chlorid-Elektrode nicht untersucht wurde [9], darf man doch unterstellen, dass beim Chlorid ähnliche Probleme wie bei der Natrium- und Calcium-Elektrode auftreten: Eine deutliche Unterschätzung der ISE-Messwerte im Beisein von Citrat (s. u.), hier 7 % Unterschätzung.
Auch die Kalium-Konzentration dürfte sich ähnlich verhalten, bei einer Verdünnung von 25 % mit einer kaliumfreien Lösung sollte die Kalium-Konzentration ca. 3,6 mmol/l betragen (4,5 : 1,25), was mit den Messwerten der ISE-Elektroden in etwa bestätigt wird. - Plasma aus der Apherese
Bei einer Plasma-Verdünnung von 11 % wäre hier eine Chlorid-Konzentration von 92,8 mmol/l zu erwarten gewesen, der entsprechende Messwert (Amsterdam) von 87,8 mmol/l liegt wieder darunter, jetzt um ca. 5 %. Hier gilt das gleiche Argument, d.h. die Chlorid-Elektrode unterschätzt den wahren Wert. Die Kalium-Konzentration verhält sich ähnlich.
Natrium
- Plasma aus der Blutspende
Es werden 63 ml CPD mit 248 ml Plasma zu 311 ml FFP zusammengefügt:
(63 ml x 284,3 mmol/l) + (248 ml x 142 mmol/l) = 311 ml x 170,8 mmol/l. - Plasma aus der Apherese
Es werden - beispielhaft - 10 ml Lösung mit 88 ml Plasma gemischt:
(10 ml x 408 mmol/l) + (88 ml x 142) = 98 ml x 169,1 mmol/l. - Natrium-Messung mit einer ionenselektiven Elektrode
In einer Arbeit [9] wird für eine wässrige Lösung, nicht Plasma, eine Unterschätzung von 30 % für eine Citrat-Konzentration von 20 mmol/l (s.u.) demonstriert, ein Wert der deutlich über der hier vermuteten Unterschätzung von knapp 10 % liegt. Als Ursache für diese Unterschätzung kommt die Änderung der Ionenstärke infrage oder die Möglichkeit, dass Na3Citrat nicht vollständig dissoziiert ist.
HCO3
- Plasma aus der Blutspende
Es werden 450 ml Blut mit 63 ml CPD gemischt, die 15,6 mmol/l Citronensäure und 16,1 mmol/l Phosphorsäure enthalten. Da die Citronensäure (H3Citrat) dreiwertig und die Phosphorsäure (NaH2PO4) zweiwertig ist, werden dem Blut somit 63 ml mit 79 mmol/l Säure-Äquivalenten zugesetzt: (63 x 79) + (450 x O) = 513 x 9,7 mmol/l. Dem Blut wird so ein BE von -9,7 mmol/l aufgezwungen. Die im Vollblut unter Lagerung bei Raumtemperatur vor der Trennung von Erythrozyten und Plasma gebildete Milchsäure erscheint im fertigen FFP mit 4 - 5 mmol/l als Laktat nach Pufferung und ist daher nur als alkalisierende Substanz beim BEpot zu berücksichtigen. Die Messwerte von [11] sind hier deshalb nicht zu vergleichen, weil dort die Plasmawerte des fertigen EK´s beschrieben sind, also nach Abtrennung von Plasma und Zugabe der weiteren, sauren Additivlösung. - Plasma aus der Apherese
Hier wird ohne Citronensäure (und Milchsäure) gearbeitet, wenn es zu einer Änderung der HCO3-Konzentration kommen sollte, dann nur aufgrund der Plasma-Verdünnung von 11 %.
Citrat und BEpot
- Plasma aus der Blutspende
Für das klassische Blutbeutelsystem, 63 ml CPD + 450 ml Blut bzw. 248 ml Plasma, ergibt dies eine Citrat-Konzentration von 21,3 mmol/l (63 ml x 105 mmol/l = 311 ml x 21,3 mmol/l). Diese Citrat-Konzentration bewirkt einen metabolisch bedingten BE von +64 mmol/l (21,3 x 3). Zusammen mit dem BE des Plasmas von ca. -10 mmol/l beträgt der BEpot damit +55 mmol/l (64 - 10 = 54 mmol/l), also ein deutlich alkalisierender Wert.
Zu diesem Wert ist das im Plasma vorhandene, ebenfalls alkalisierende Laktat zu addieren, also ca. 6 mmol/l (4 - 8), daraus ergibt sich dann ein BEpot von +60 mmol/l. - Plasma aus der Apherese
Hier fällt die Bilanz folgendermaßen aus (Beispiel Amsterdam):
Die Plasma-Verdünnung beträgt hier nur 1,11. Dementsprechend erscheinen im FFP nur ca. 14 mmol/l Citrat. Es werden - beispielhaft - 10 ml Lösung mit 88 ml Plasma gemischt: 10 ml x 136 mmol/l = 98 ml x 13,9 mmol/l. Dieser Wert ist offensichtlich realistisch: Nach [1] genügen von der 4 % Citrat-Lösung (und sind dann optimal) 10,4 % des Plasmavolumens entsprechend 14,1 mmol/l Citrat, von den Autoren mit 14,2 mmol/l tatsächlich gemessen.
Dieses Citrat bewirkt einen metabolischen BE von +42 mmol/l. Zusammen mit dem Blut mit einem BE von angenähert 0 mmol/l ergibt dies einen BEpot von +42 mmol/l. Laktat spielt hier keine Rolle.
Glukose
Wegen der unterschiedlichen Wasserkonzentrationen in der CPD-Lösung, dem Plasma und den Erythrozyten, muss die Bilanz mit der Angabe mosmol/kg H2O ermittelt werden. Die Wasser-Konzentrationen betragen (als Fraktion) 0,986 für CPD, Plasma 0,94 und Erythrozyten nur 0,71 und für das FFP (gemessen) 0,951 (berechnet 0,949).
- Plasma aus der Blutspende
Die Glukose-Konzentrationen betragen für CPD 128,7 mmol/l = 130,5 mmol/kg H2O, für Plasma 5 mmol/l = 5,3 mmol/kg H2O und damit für Erythrozyten (im Gleichgewicht mit Plasma) ebenfalls 5,3 mmol/kg H2O (= 7,5 mmol/l).
Die Bilanz lautet: (63 ml x 130,5 mmol/kg H2O) + ( 450 ml x 5,3 mmol/kg H2O) = 513 ml x 20,7 mmol/kg H2O. Damit beträgt die zu erwartende, gemessene Glukose-Konzentration 19,7 mmol/l (20,7 x 0,951 Wassergehalt).
Die sehr gute Übereinstimmung mit dem Messwert von 19,2 mmol/l (Langen) spricht für die Bilanzierung unter Verwendung der Volumina (63 CPD + 248 Plasma + 202 Erythrozyten) und der Glukose-Konzentrationen.
Bei der Messung der Osmolalität des FFP ist somit eine glukosebedingte Erhöhung gegenüber dem Normalwert von 288 (incl. 5 mosmol/kg H2O für Glukose) von 15 mosmol/kg H2O zu erwarten. Diese Erhöhung hat aber keine Bedeutung, weil sich diese zusätzliche Konzentration gleichmäßig zwischen Plasma und Erythrozyten verteilt, also osmotisch nicht wirksam wird. - Plasma aus der Apherese
Hier wird die normale Plasma-Glukose-Konzentration des Spenders (5 mmol/l) in das FFP übernommen.
Osmolalität
Glukose und Citrat werden beide bei der Messung der Osmolalität des FFP mit erfasst. Die Glukose übt, wie bereits erwähnt, keinen osmotischen Effekt aus, weil sie zwischen Erythrozyten und Plasma ausgetauscht wird. Auch nach späterer Transfusion übt sie keinen osmotischen Effekt aus, weil sie – zumindest bis zur physiologischen Konzentration von 5 mmol/l – rasch ins Gewebe diffundiert und dort metabolisiert wird. Citrat hingegen gelangt nur ins Plasma und kann nur dort die Osmolalität erhöhen, um dann anschließend über eine Wasserdiffusion aus den Erythrozyten mit diesen in Kontakt zu treten.
Citrat wird bei der Messung bei der Blutspende mit 21 mmol/l und somit 57 mosmol/kg H2O erfasst (21 x 4 x 0,681) bzw. bei der Apherese mit 14 mmol/l und 38 mosmol/kg H2O (14 x 4 x 0,681) (s. Tabelle 2).
- Plasma aus der Blutspende
Da die CPD-Lösung ohne Glukose (nicht wirksam) mit 4 % nur leicht hyperton ist (300 mosmol/kg H2O, s. Anlage II), wird die Osmolalität des FFP nur unwesentlich erhöht, wie die Bilanz zeigt: (63 ml x 300) + (248 ml x 288) = 311 x 290 mosmol/kg H2O.
Der Messwert von 315 - 317 mosmol/kg H2O (Solingen, München) ist daher realistisch, weil zu den vorhergesagten 290 mosmol/kg H2O noch 16 mosmol/kg H2O für die Glukose zu addieren sind, die messtechnisch erfasst werden (also 306).
In diesem Messwerte von 316 mosmol/kg H2O sind die 57 mosmol/kg H2O für 21 mmol/l Citrat (s.u.) enthalten, die osmotisch wirksam sind.
Anders formuliert: Der Messwert von 316 mosmol/kg H2O für das FFP bedeutet, dass die wahre Osmolalität nur 300 mosmol/kg H2O beträgt, nämlich 316 minus nicht wirksame Glukose von 16 mosmol/kg H2O, also eine recht gute Übereinstimmung mit der Vorhersage von 290 mosmol/kg H2O. - Plasma aus der Apherese
Der Messwert (Amsterdam) von 304 mosmol/kg H2O ist wie folgt zu interpretieren:
Die Osmolalität der 4%igen Citrat-Lösung ist mit 370 mosmol/kg H2O sehr hoch, allein auf das Citrat (keine Glukose) zurückzuführen. Wenn rechnerisch 10 ml mit 370 mosmol/kg H2O mit 88 ml Plasma mit 288 mosmol/kg H2O (Normalwert) zu 98 ml zusammengeführt werden, dann resultiert daraus eine neue Plasma-Osmolalität von 296 mosmol/kg H2O, die sofort osmotisch ausgeglichen werden muss. Dieser Ausgleich kann nur durch eine Diffusion von H2O aus den Erythrozyten in das Plasma erfolgen. Die gemeinsame Osmolalität würde dann 293 mosmol/kg H2O betragen, eine recht gute Übereinstimmung mit dem Messwert (Amsterdam) von 304 mosmol/kg H2O.
Facit unter Verwendung der gemessenen Daten aus Amsterdam:
Unter der Apherese werden an den Spender Erythrozyten abgegeben, die infolge Osmose um ca. 5 % geschrumpft sind (MCV von 90 auf 85,5 fl vermindert). Das FFP aus der Apherese ist mit 304 mosmol/kg H2O um ca. 5 % hyperosmolal.
In vivo-Osmolalität
Unter der in vivo-Osmolalität wird der Effekt verstanden, dass der Metabolismus eines Osmols mehr als ein Osmol ergibt. Dies ist beim Citrat der Fall: Aus 1 Mol Citrat entstehen vornehmlich im Metabolismus der Leber 3 Osmol HCO3.
- Beim Blutspende-FFP entstehen somit aus 21 mmol/l Na3Citrat mit einer Osmolalität von 57 mosmol/kg H2O (21 x 4 x 0,681) im Metabolismus 63 mmol/l NaHCO3 mit einer Osmolalität von 117 mosmol/kg H2O (63 x 2 x 0,926). Dies erhöht die Osmolalität in vivo damit um 60 mosmol/kg H2O (117 - 57) auf insgesamt 350 mosmol/kg H2O (290 + 60).
- Für das Apherese-FFP macht dies bei 14 mmol/l Citrat und einer Osmolalität von 38 mosmol/kg H2O (14 x 4 x 0,681) und folglich 42 mmol/l NaHCO3 dann 78 mosmol/kg H2O (42 x 2 x 0,926) aus, was die Osmolalität in vivo dann um 40 mosmol/kg H2O (78 - 38) auf insgesamt 344 mosmol/kg H2O erhöht (304 + 40).
- Beim CitrISO-FFP wären das dann bei 10 mmol/l Citrat und einer Osmolalität von 27 mosmol/kg H2O (10 x 4 x 0,681) für das entstehende NaHCO3 56 mosmol/kg H2O (30 x 2 x 0,926), was die ursprüngliche Osmolalität um 29 (56 - 27) auf dann 317 mosmol/kg H2O (288 + 29) erhöhen würde. De facto wären dann, abgesehen vom CitrISO-FFP mit 317 mosmol/kg H2O, beide FFPs in vivo sehr deutlich hyperosmolal, nämlich mit 344 bzw. 350 mosmol/kg H2O.
Anhang II: Zahlen- und Rechenwerte

De facto-Zusammensetzung von CPD (persönliche Mitteilung W. Lang, Mainz):
Diese Mischung von Citrat, Citronensäure (pK-Werte bei 37 °C: 3,0 - 4,4 - 5,8) und NaH2PO4 führt zu folgender Zusammensetzung:
NaH2Citr = 1,4 mmol/l; NaH2PO4 = 14,4 mmol/l; Na2HCitr = 45,7 mmol/l; Na2HPO4 = 1,7 mmol/l; Na3Citr = 57,9 mmol/l
Hierbei handelt es sich um eine stark saure Lösung (pH 5,87), die zudem gut gepuffert, vornehmlich zwei Säuren enthält (Na2HCitr und NaH2PO4), die im Plasma vorhandenes HCO3 partiell austreiben dürften.
Osmotische Koeffizienten
(eigene Mess- und Rechenwerte)
Arg3Citrat (4) = 0,833; Na3Citrat (4) = 0,681; H3Citrat (3) = 0,555; NaH2PO4 (2) = 0,915; NaHCO3 (2) = 0,926; NaCl (2) = 0,926; Glukose (1) = 1,013
Osmolalitäten
CPD ohne Glukose
Berechnung: (89,4 x 4 x 0,681) + (15,6 x 3 x 0,555) + (16,1 x 2 x 0,915) = 299 mosmol/kg H2O
Eigener Messwert: 300 mosmol/kg H2O
CPD mit Glukose
128,7 mmol/l = 130,5 mosmol/kg H2O x 1,013 = 132,2 mosmol/kg H2O
132,2 + 300 = 432 mosmol/kg H2O
4 % Na3Citrat
Berechnung: (136 x 4 x 0,681) = 370 mosmol/kg H2O
ACD-A
Berechnung: (74,8 x 4 x 0,681) + (38,1 x 3 x 0,555) = 267 mosmol/kg H2O
Wassergehalt (F)
Plasma 0,94; Erythrozyten 0,71; FFP-Plasma 0,951; CPD 0,986
Laktat-Konzentration: Plasma versus Blut
Wegen der ungleichen Verteilung des Laktats zwischen Erythrozyten und Plasma, die Erys enthalten nur 43 % des Plasmawertes, kann man den Plasmawert bei Kenntnis des Hämatokrits (Hct) wie folgt berechnen [10]:
cLakt (Plasma) = cLakt (Blut) / (1 - 0,57 x Hct).
Daraus ergibt sich für eine Blutprobe mit einem Hct von 45 % (als Fraktion einzugeben) ein Faktor von 1,34.
Literatur
- Beeck H, Becker T, Kiessig ST, Kaeser R, Wolter K, Hellstern P
The influence of citrate concentration on the quality of plasma obtained by automated plasmapheresis: a prospective study
Transfusion 1999; 39: 1266 - 1270 - Bux J, Dickhörner D, Scheel E
Quality of freeze-dried (lyophilized) quarantined single-donor plasma
Transfusion 2013; 53: 3203 - 3209 - Ewalenko P, Deloof T, Peeters J
Composition of fresh frozen plasma
Crit Care Med 1986; 14: 145 - 146 - Gattioni L, Carlesso E, Maiocchi G, Polli F, Cadringher P
Dilutional acidosis: where do the protons come from?
Intensive Care Med 2009; 35: 2033 - 2043 - Hauben DJ, Yanai E, Mahler D et al.
The constituents of fresh frozen plasma stored with citrate phosphate dextrose and their clinical implications
Vox Sang 1982; 42: 81 - 86 - Heger A, Bailey L, Gregori M et al.
OctaplasLG: Improvement of biochemical quality and pathogen safety
Abstract: XXXth International Congress of the ISBT 2010 - Kramer L, Bauer E, Joukhadar C et al.
Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients
Crit Care Med 2003; 31: 2450 - 2455 - Lachtermann E, Zander R
Milchsäure-Bildung und -Verteilung in Erythrozytenkonzentraten
Anästhesiol Intensivmed Notfallmed Schmerzther 2001; 36 (Suppl. 1): 31 - 33 - Zander R
Meßfehler bei der Bestimmung von Elektrolytkonzentrationen mit ionenselektiven Elektroden (ISE) bei Anwesenheit von anorganischen oder metabolisierbaren Anionen
Infusionsther 1992; 19: 221 - 225 - Zander R, Thews O
Gerätetest: Mobile Laktat-Messgeräte
QualiTest 9, 2006 - Zander R, Sümpelmann R
Säure-Basen-Status gelagerter und gewaschener Erythrozyten
Anästhesiol Intensivmed Notfallmed Schmerzther 2001: 36 (Suppl. 1): 25 - 30
Danksagung
Für die großzügige Übermittlung von Messwerten wird hiermit gedankt:
Dr. med. Franz Brettner (Krankenhaus Barmherzige Brüder München)
Prof. Dr. med. Dr. rer. nat. Markus W. Hollmann (Academic Medical Center Amsterdam)
Prof. Dr. med. H.B. Hopf (Asklepios Klinik Langen)
OFA J. Kerschowski (Bundeswehrkrankenhaus Ulm)
Dr. med. Dietmar Schürmann (Borromäus Hospital Leer)
Prof. Dr. med. Thomas Standl (Städtisches Klinikum Solingen)
Prof. Dr. med. Volker Wenzel (Medizinische Universität Innsbruck)
