
Eliminationsorgane
In körperlicher Ruhe eliminieren unter physiologischen Bedingungen in der Reihenfolge ihrer Bedeutung für die Regulation des Säure-Basen-Haushaltes
- die Lunge ca. 10 mmol (224 ml) CO2 pro Minute
- die Leber ca. 40 mmol H+ (als Milchsäure) pro Stunde und
- die Nieren ca. 40 - 80 mmol H+ (als H2PO4- bzw. NH4+) pro Tag.
Für die klinische Praxis bedeutet dies, dass sich im Säure-Basen-Haushalt eine Funktionsstörung der Lungen im wenigen Minuten, eine der Leber in Stunden und eine der Nieren erst in Tagen bemerkbar machen wird.
Zum besseren Verständnis der Regulation des Säure-Basen-Haushaltes sollen die beteiligten Organe bezüglich ihrer Regulationsmöglichkeiten besprochen werden.
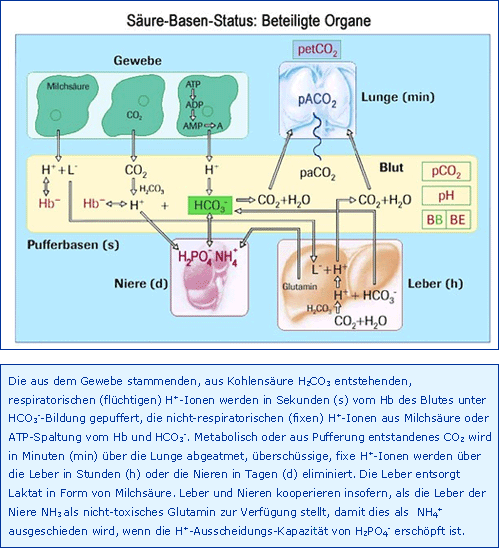
Lunge
Unter physiologischen Bedingungen, insbesondere des Ventilations-Perfusions-Verhältnisses, gewährleistet die Lunge einen alveolären und damit praktisch identischen arteriellen pCO2 von 40 mmHg (die physiologische AaDCO2 beträgt weniger als 1 mmHg). Jede Änderung der CO2-Produktion wird automatisch mit einer Änderung der Ventilation beantwortet. Auf diese Weise ist sichergestellt, dass auch sehr hohe gemischt-venöse pCO2-Werte, infolge erhöhter CO2-Freisetzung im Gewebe bzw. EZR oder infolge einer Abnahme des Herzminutenvolumens, in jedem Falle auf arteriell 40 mmHg normalisiert werden.
Leber
Die Leber als wesentliches Stoffwechselorgan greift zwangsläufig in den Säure-Basen-Haushalt ein. Bei normaler Nahrungszufuhr werden pro Tag 50 bis 100 mmol H+ im Überschuss produziert, die vor allem dem Proteinstoffwechsel entstammen, während die H+-Bilanz des Abbaus von Kohlenhydraten und Fetten praktisch ausgeglichen ist. Für die klinische Praxis sind drei Aspekte wichtig, nämlich die Harnstoffsynthese einerseits und der Metabolismus von Aminosäuren und organischen Anionen andererseits. Zum besseren Verständnis ist allerdings eine wichtige Vorbemerkung notwendig: Die Leber kann im oxidativen Stoffwechsel grundsätzlich nur ungeladene Substanzen umsetzen, d. h. alle metabolisierbaren Anionen (Basen) werden erst nach Aufnahme von H+ und alle metabolisierbaren Kationen (Säuren) nur nach Abgabe von H+ verstoffwechselt.
Harnstoffsynthese
Seit Jahren hat sich bezüglich der hepatischen Harnstoffsynthese eine Diskussion daran entzündet, ob Harnstoff gemäß bisheriger Annahme ("traditionell") neutral aus 1 mol CO2 plus 2 mol NH3 entsteht oder aus äquimolaren Mengen von HCO3- und NH4+ ("modern"), eine Annahme, die einen erheblichen Einfluss auf den Säure-Basen-Haushalt haben sollte.
Abgesehen von der scheinbar rein stöchiometrischen Diskussion, ergeben sich daraus kaum haltbare Folgerungen: Während HCO3- auf der einen Seite als "Abfallprodukt" bezeichnet wird [Gerok, Häussinger 1987], das metabolisch entstanden über die Harnstoffsynthese eliminiert werden muss, wird an anderer Stelle HCO3- als eine "kostbare" extrazelluläre Pufferbase eingestuft [Zander 1993 (B)], deren Bestand dem Organismus durch die Niere unter hohem Energieaufwand erhalten werden muss. Es konnte belegt werden [Zander 1995 (D)], dass die tägliche Harnstoffsyntheseleistung von ca. 20 g (330 mmol) keinen Einfluss auf den Säure-Basen-Haushalt nehmen kann.
Aminosäuren
Die bei der Hydrolyse von Proteinen entstehenden bipolaren, neutralen Aminosäuren liefern im Metabolismus bei vollständiger Oxidation die Endprodukte CO2 und NH3 bzw., gemäß Tab. Stoffwechselendprodukte nach Hydratisierung, Assoziation und Dissoziation, die Reaktionspartner NH4+ und HCO3- in etwa äquimolaren Mengen. Entscheidend ist, dass sowohl die Endprodukte als auch die Reaktionspartner keinen Einfluss auf den Säure-Basen-Haushalt ausüben können, da H+-Ionen weder freigesetzt noch verbraucht werden.
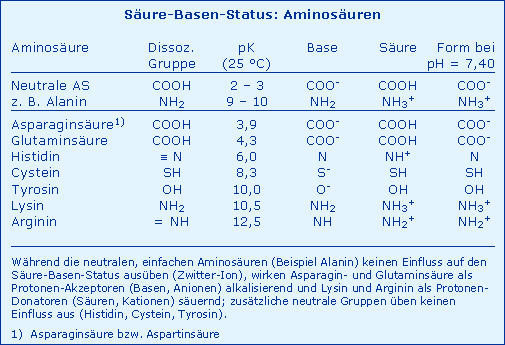
Die Verhältnisse ändern sich dann, wenn die Aminosäuren (AS) zusätzliche dissoziierende Gruppen enthalten. Die entsprechenden Möglichkeiten sind in Tab. Aminosäuren im Vergleich zu Alanin als einer AS mit unpolaren Seitenketten zusammengestellt. Es ist offensichtlich, dass Asparagin- und Glutaminsäure im physiologischen pH-Bereich als Basen (Anionen) vorliegen, d. h. als Protonen-Akzeptoren. Um als neutrale Substanzen metabolisiert werden zu können, müssen sie H+-Ionen aufnehmen, also verbrauchen. Somit entwickeln sie im Metabolismus eine alkalisierende Wirkung. Umgekehrt liegen Lysin und Arginin als Säuren, Protonen-Donatoren (Kationen) vor, sie setzen im neutralen Metabolismus H+-Ionen frei, d. h. sie entwickeln eine ansäuernde Wirkung.
Zusätzlich müssen die schwefelhaltigen AS weitere H+ freisetzen, nämlich 2 mol H+ pro 1 mol SO3. Diese Tatsachen sind deshalb von Bedeutung, weil dem Patienten derartige AS enteral oder parenteral zugeführt werden.
Organische Säuren und ihre Anionen
Organische Säuren werden im Lebermetabolismus prinzipiell vollständig zu CO2 und H2O metabolisiert (oxidiert), eine Ausnahme bildet nur die Milchsäure, die zusätzlich auch zur Glukoneogenese verwandt werden kann. Da auch die zugehörigen Anionen (Salze) nur als Säuren metabolisiert werden können, werden bei ihrer Oxidation unterschiedliche Mengen an H+ verbraucht, wie dies in Tab. Metabolisierbare Anionen dargestellt ist.

Die klinische Bedeutung dieser sogenannten metabolisierbaren Anionen ergibt sich aus der Tatsache, dass sie breite Verwendung finden: Infusionslösungen enthalten Azetat, Laktat oder Malat mit Konzentrationen weit über 100 mmol/l, gelagertes Blut, Frischplasma oder Thrombozytenkonzentrate Zitrat bis ca. 15 mmol/l und Dialysierflüssigkeiten Azetat oder Laktat mit Konzentrationen bis zu 50 mmol/l. Wegen der besonderen Bedeutung der Leber im Milchsäure- bzw. Laktat-Metabolismus soll auf dieses Beispiel einer organischen Säure genauer eingegangen werden.
Die unter hypoxischen Bedingungen im Gewebe vermehrt entstehende Milchsäure liegt bei pH-Werten zwischen 6 und 8 vollständig dissoziiert vor (pK 3,7), d. h. als Laktat- und H+. Diese H+-Ionen führen zu der bekannten Azidose, richtig bezeichnet als Lakt-Azidose (für Milchsäure) und nicht Laktat-Azidose (für Laktat).
Ist die Leber funktionstüchtig, d. h. nicht auch hypoxisch gestört, so wird die Milchsäure oxidativ zu CO2 und H2O verstoffwechselt oder zur Glukoneogenese benutzt, wodurch der gesunkene pH-Wert (Azidose) normalisiert wird. In beiden Fällen, oxidativer Metabolismus oder Glukoneogenese, wird pro 1 mol Laktat 1 mol H+ verbraucht, nämlich 2 mol Laktat + 2 mol H+ ergeben 1 mol Glukose oder 1 mol Laktat + 1 mol H+ + 3 mol O2 ergeben jeweils 3 mol CO2 und H2O.
Wird dem Organismus hingegen enteral oder parenteral Laktat zugeführt, so kommt es primär zu keiner Änderung des pH-Wertes. Erst sekundär, d. h. im Laufe von Minuten bis Stunden, wenn das Laktat als Milchsäure im Stoffwechsel metabolisiert wird, werden die äquimolaren H+-Ionen dem Extrazellularraum entzogen, damit werden HCO3--Ionen freigesetzt (aus H2CO3) und der pH-Wert steigt im Sinne einer Alkalose. Das Ausmaß der infolge Zufuhr dieser Base Laktat entstehenden Alkalose hängt natürlich von der Geschwindigkeit und Menge des zugeführten Laktats ab. Der hepatische Umsatz und damit HCO3--Freisetzung beträgt je nach metabolisierbarem Anion pro Stunde bei Laktat bis ca. 400 mmol, bei Malat bis ca. 1.000 mmol (zweiwertig) und bei Azetat bis ca. 5.000 mmol. Natürlich ist ein intakter Leberstoffwechsel Voraussetzung für den Metabolismus der genannten Basen organischer Säuren oder Aminosäuren. Störungen der O2-Versorgung, Intoxikationen, Leberversagen, Leberparenchymschäden etc. schalten diesen Metabolismus frühzeitig aus.
Niere
Die Hauptaufgabe der Nieren besteht darin, dem Körper den extrazellulären Bikarbonatvorrat zu erhalten: Bei einer Filtration des Primärharns von 125 ml/min (Inulin-Clearance) werden täglich 180 l Primärharn gebildet, dessen HCO3--Konzentration der des Extracellularraumes mit 25 mmol/l entsprechen muss (zum Vergleich: das eiweißhaltige Plasma weist eine HCO3--Konzentration von 24 mmol/l auf). Die sich daraus pro Tag ergebenden 4.500 mmol HCO3- werden unter physiologischen Bedingungen unter großem Energieaufwand praktisch vollständig rückresorbiert.
Der Grundmechanismus dieser erheblichen Transportleistung besteht (vor allem im proximalen Tubulus) in einer Sekretion von H+-Ionen, die in Verbindung mit HCO3- zusammen H2CO3 bilden und mit Karboanhydrase schnell in CO2 und H2O dehydratisiert werden. Diese Reaktion im geschlossenen System führt zu einem drastischen Anstieg des pCO2: Pro 1 mmol sezerniertem H+ wird 1 mmol CO2 gebildet, was zu einem pCO2-Anstieg von 33 mmHg führen muss. Dieser hohe pCO2 wirkt als treibende Kraft für eine CO2-Diffusion in die Tubuluszellen und weiter in das Blut. Da das CO2-Aufnahmevermögen von Blut fast zehnmal größer ist als das der Extrazellularflüssigkeit bzw. des Primärharns, wird die Diffusion von CO2 vom Ort der Produktion mit hohem pCO2 sehr effektiv zum Blut mit kleinem pCO2 unterstützt.
Wird die im Bürstensaum der Tubuluszelle lokalisierte Karboanhydrase mit Acetazolamid (Diamox) gehemmt, kommt es logischerweise zu einer Ausscheidung von HCO3- mit folgender Diurese, da zwar H2CO3 gebildet, die Dehydratisierung in CO2 + H2O aber nicht schnell genug erfolgt. Für diesen Bikarbonat-Sparmechanismus muss die Niere somit pro Tag 4.500 mmol H+-Ionen sezernieren, ohne dass der Säure-Basen-Haushalt damit verändert worden wäre.
Ausgehend von dieser ausgeglichenen Bilanz kann die Niere entweder HCO3- ausscheiden, allein durch Unterlassung der beschriebenen H+-Sekretion, oder zusätzliche H+-Ionen eliminieren, allerdings unter zusätzlichem Energieaufwand. Da eine Ausscheidung als freie H+-Ionen praktisch nicht möglich ist, müssen diese dann nach Bindung an NH3 als NH4+ oder nach Bindung an HPO42- als H2PO4- eliminiert werden.
Kooperation zwischen den Organen
Immer dann, wenn eines der beschriebenen Organe in seiner Funktion eingeschränkt ist, kann ein anderes kompensatorisch eingreifen. Kompensatorisch heißt, dass die ursprüngliche Störung des Säure-Basen-Haushaltes bestehen bleibt, z. B. eine Azidose oder eine Alkalose, der entgleiste pH-Wert aber in Richtung Normalwert korrigiert wird. Dabei ist es logisch, dass die mögliche Kompensation einer Störung durch ein nicht gestörtes Organ in der Reihenfolge seiner Eliminationskapazität für H+-Ionen erfolgen muss: Sie beträgt etwa für die Lunge (224 ml/min) 10 mmol/min, für die Leber 400 mmol/h und für die Niere 500 mmol/d.
Damit unterscheiden sich die Eliminationskapazitäten für H+-Ionen der Lunge, Leber und Niere wie Minute zu Stunde zu Tag.
Voraussetzung dafür ist, dass die genannten Organe normal durchblutet werden, nämlich die Lunge mit 100 % des Herzminutenvolumens und Leber und Niere mit ca. 25 % desselben, wobei bei der Leber ca. 75 % auf die Vena portae und 25 % auf die Arteria hepatica entfallen.
Respiratorische Kompensation
Jede Abnahme des pH-Wertes infolge einer nicht-respiratorischen Azidose wird in wenigen Minuten mit einer Hyperventilation, jeder Anstieg des pH-Wertes infolge einer nicht-respiratorischen Alkalose mit einer Hypoventilation beantwortet. Die Hypoventilation wird limitiert durch einen Abfall des arteriellen pO2 und damit O2-Sättigung des Blutes (s. u.). Auf diese Weise kann der pH-Wert in einem teilweise kompensierten Bereich von ca. 7,30 bis 7,50 gehalten werden.
Die zusätzliche Elimination von CO2 ist besonders schnell und effektiv: Eine in Sekunden einsetzende Änderung der alveolären Ventilation bzw. Beatmung mit Senkung des alveolären pCO2 von 40 auf 34 mmHg verdoppelt in etwa die gemischtvenöse-alveoläre CO2-Partialdruckdifferenz und damit die CO2-Abgabe über die Lunge, bis sich das neue Gleichgewicht (paCO2 34 mmHg) im Organismus eingestellt hat.
Die respiratorische Kompensation kann in allen nicht-respiratorischen Fällen eingesetzt werden, also bei metabolischen, renalen und intestinalen Störungen (s. u.).
Nicht-respiratorische Kompensation
Im Gegensatz zur Lunge können die Organe Leber und Niere sowohl respiratorische als auch nicht-respiratorische Störungen kompensieren. Die jeweilige Eliminationskapazität beider Organe kann wie folgt quantifiziert werden.
Ausgehend von einer ausgeglichenen Bilanz kann die Niere entweder HCO3- ausscheiden, oder durch zusätzliche Ausscheidung von H+-Ionen freisetzen.
Eine Ausscheidung von HCO3- im Urin erfolgt erst dann, wenn die sogenannte Nierenschwelle für HCO3- überschritten wird, also diejenige Plasma-HCO3--Konzentration, oberhalb derer die physiologische, vollständige HCO3--Rückresorption überfordert ist. Im Gegensatz zur gängigen Lehrmeinung wird diese mit 25 mmol/l angenommen. Sie wird zusätzlich vom pCO2 des arteriellen Blutes bestimmt, der ja seinerseits die Plasma-HCO3--Konzentration mitbestimmt [Zander 1993 (B)].
Unter Annahme eines maximalen Urin-pH von 8,0 und -pCO2 von 100 mmHg kann daraus eine maximale Konzentration für HCO3- von 250 mmol/l abgeleitet werden, also eine Eliminationskapaziät für HCO3- von maximal 500 mmol pro Tag (Urinvolumen 2 l). Eine zusätzliche H+-Ionen Ausscheidung durch die Niere hat zum Ziel, HCO3- freizusetzen und damit die extrazelluläre HCO3--Konzentration wieder anzuheben. Bei einem minimalen Urin-pH von 4,5 können H+-Ionen in Form von NH4+ oder H2PO4- mit einer maximalen Eliminationsrate von ebenso ca. 500 mmol pro Tag (Urinvolumen 2 l) ausgeschieden werden.
Der physiologische, hepatische Umsatz von Milchsäure, wiederum im Sinne einer HCO3--Freisetzung, beträgt in körperlicher Ruhe ca. 40 mmol pro Stunde mit einer maximalen Steigerung auf ca. 400 mmol pro Stunde.
Die Organe Leber und Niere haben damit eine Ausscheidungskapazität für H+-Ionen, die wie Stunde zu Tag differieren: 400 mmol/h für die Leber und 500 mmol/d für die Niere. Da die Organe Leber und Niere gemeinsam respiratorische Störungen ausgleichen können, muss es auch noch eine Kooperation zwischen beiden Organen geben. Diese scheint über Glutamin als nichttoxische Transportform für Ammonium zu erfolgen. Bei Drosselung der Harnstoffsynthese in der Leber kann Ammonium zunehmend über eine Glutaminbildung entgiftet werden und eine vermehrte Glutaminspaltung in der Niere zu einer Ammoniumausscheidung über die Niere führen.
Bei chronischer Azidose kann die Niere auf diese Weise zusätzlich H+-Ionen eliminieren. Umgekehrt bei Alkalose wird die Leber zum glutaminverbrauchenden Organ.
