
Osmolalität aktueller balancierter Infusionslösungen
Bereits 2005 wurden in einem Beitrag zum Thema Intrakranieller Druck und Osmolalität von Infusionslösungen Daten zur Osmolarität bzw. Osmolalität von Infusionslösungen veröffentlicht. Dieses Thema wird jetzt nochmals aufgegriffen, weil in der jüngsten Vergangenheit mehrere neue, so genannte balancierte Lösungen auf den Markt gekommen sind. Mit diesen balancierten Lösung wird versucht, die physiologische Zusammensetzung des Plasmas (Kolloide) oder der Extrazellular-Flüssigkeit (Kristalloide) möglichst optimal nachzubilden. Da dies aus galenischen Gründen nur mit einem Zweikammer-Konzept zu erreichen ist (Optimierte Lösungen), macht jeder Hersteller beim üblichen Einkammer-Produkt einen oder mehrere Kompromisse. Diese betreffen, in der Reihenfolge ihrer Bedeutung, den Säure-Basen-Status (BEpot 0 ± 10 mmol/l), die Osmolalität (290 ± 10 mosmol/kg H2O), die Konzentrationen von Chlorid (103 ± 3 mmol/l), Kalium (4,5 ± 0,5 mmol/l), Natrium (142 ± 4 mmol/l), Calcium (2,5 mmol/l) oder Phosphat (ca. 1 mmol/l) [6].
In einer Konsensus-Veröffentlichung aus dem Jahre 2005 wurde neben anderen eine obligatorische Forderung nach Isotonie abgeleitet [Zander et al. 2005]. Inwieweit diese heute von den so genannten balancierten Lösungen erfüllt wird, wird nachfolgend gezeigt.
Obligatorische Forderung nach Isotonie
Eine obligatorische Forderung an eine optimale Infusionslösung lautet [Zander et al. 2005]: Jede Infusionslösung sollte isoton sein. Eine Lösung ist dann isoton, wenn ihre kryoskopisch (Gefrierpunktserniedrigung, GPE) gemessene (reale) Osmolalität im Vergleich zu allen Körperflüssigkeiten des Menschen einschließlich Plasma mit 288 ± 5 mosmol/kg H2O in einem Bereich von 280 - 300 mosmol/kg H2O liegt. Die Isotonie wird mit der berechneten realen Osmolalität (mosmol/kg H2O) deklariert.
Diese Forderung wird zur Zeit von keinem Hersteller erfüllt, stattdessen wird üblicherweise nur die theoretische Osmolarität deklariert, die sich aus der Addition aller osmotisch wirksamen Bestandteile einer Lösung ergibt.
Osmolarität (mosmol/l) und Osmolalität (mosmol/kgH2O)
Das osmotische Gleichgewicht zwischen den verschiedenen Kompartimenten des Organismus ist dann gegeben, wenn die Anzahl der osmotisch wirksamen Teilchen (Osmole) im zur Verfügung stehenden Wasserraum ausgeglichen ist. Beispielsweise steht die frei permeable Glukose dann zwischen Erythrozyt (Wassergehalt 71 %) und Plasma (Wassergehalt 94 %) im Gleichgewicht, wenn die Konzentrationen im zur Verfügung stehenden Wasserraum gleich sind. Daher ist der Bezug auf ein Kilogramm Wasser, also Osmolalität (mosmol/kg H2O) physiologisch erforderlich, der Bezug auf ein Liter Erythrozyt oder Plasma würde sehr unterschiedliche Konzentrationen ergeben. Tatsächlich wurde der experimentelle Nachweis erbracht, dass alle Körperflüssigkeiten einschließlich Erythrozyten in keinem Falle eine Abweichung von mehr als 1 mosmol/kg H2O vom Plasmawert eines Probanden aufweist [4].
Am Beispiel von Plasma sollen die Begriffe Osmolarität versus Osmolalität sowie theoretisch versus real demonstriert werden.
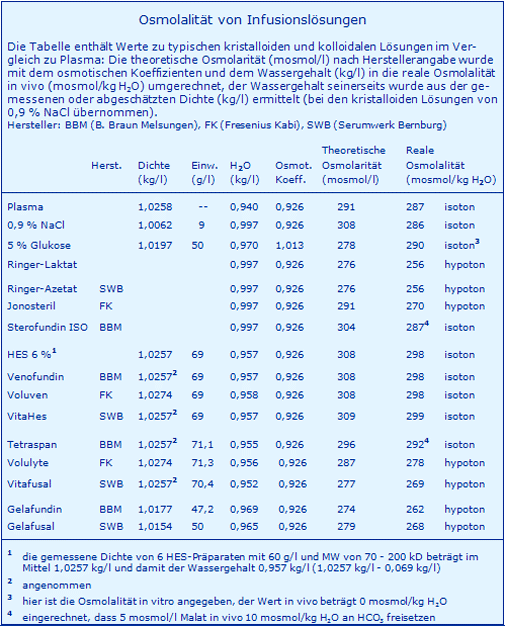
Die theoretische Osmolarität von 291 mosmol/l kann aus der Addition aller osmotisch wirksamen Substanzen bezogen auf 1 Liter Plasma berechnet werden (142 Na, 4,5 K, 1,3 ionisiertes Ca, 0,7 ionisiertes Mg, 103 Cl, 24 HCO3, 1,5 Laktat, 1 HPO4, 0,5 SO4, 2,5 organische Säuren und Protein, 5 Glukose, 5 Harnstoff). Unter Berücksichtigung des Wassergehaltes von 94 % ergibt dies eine theoretische Osmolalität von 310 mosmol/kg H2O, also eine Erhöhung des Wertes, weil der zur Verfügung stehende Raum um 6 % verkleinert wurde. Da die Elektrolyte, vor allem Natrium und Chlorid nur zu einem Teil osmotisch aktiv sind, nämlich nur zu 92,6 % (osmotischer Koeffizient 0,926) [1], beträgt die reale Osmolalität nur noch 287 mosmol/kg H2O. Der Vergleich mit dem gemessenen realen Normalwert des Plasmas von 288 mosmol/kg H2O führt zu dem überraschenden Ergebnis, dass die Plasma-Osmolalität und -Osmolarität zufällig praktisch identisch sind, was vermutlich einen Teil der Verwirrung in der Literatur erklärt. Über die Erniedrigung des Gefrierpunktes (Gefrierpunktsdepression) kann die reale Osmolalität (nicht Osmolarität) gemessen werden.
Der Normalwert der realen Osmolalität des Plasmas beträgt 288 ± 5 mosmol/kg H2O mit einer mittleren Streuung (SD) von nur 1,8 %, wobei es sich um einen gewichteten Mittelwert für 181 Probanden handelt [2, 3, 5].
Eine 0,9 %ige NaCl-Lösung mit 308 mosmol/l (je 154 Na und Cl) weist, umgerechnet mit dem osmotischen Koeffizienten von 0,926 bei einem Wassergehalt von 99,7 %, eine Osmolalität von 286 mosmol/kg H2O auf, ist also isoton.
Osmolalität in vivo versus in vitro
Leider kann zwischen der in vitro gemessenen Osmolalität einer Infusionslösung und ihrer Wirkung in vivo ein Unterschied bestehen, was an einigen Beispielen erläutert werden soll.
Der einfachste Fall ist die 5 %ige Glukose-Lösung: Sie enthält theoretisch 278 mmol gleich mosmol pro Liter Lösung, also eine Osmolarität von 278 mosmol/l. Unter Berücksichtigung des Wassergehaltes von 97 % und einem osmotischen Koeffizienten von 1,013 (deutlich abweichend von NaCl) [1] ergibt dies eine reale Osmolaliät von 290 mosmol/kg H2O, also eine eindeutig isotone Lösung, mehrfach in vitro gemessen. Die Infusion dieser Lösung aber hat eine Wirkung wie reines Wasser, weil die Glukose schnell intrazellulär im Gewebe metabolisiert wird und das Wasser extrazellulär zurückbleibt.
Würde eine Infusionslösung einen Zusatz von je 5 mosmol/kg H2O von Glukose oder Harnstoff erhalten, so würde dies einer Osmolaliät von zusätzlich je 5 mosmol/kg H2O entsprechen, weil das Plasma diese beiden Komponenten auch enthält und beide Substanzen im Konzentrations-Gleichgewicht mit dem Intrazellularraum stehen. Enthält eine Infusionslösung als Bikarbonat-Ersatz 24 mmol/l Laktat oder Azetat, dann ändert dies an der Osmolalität nichts, weil der intrazelluläre Metabolismus von Laktat oder Azetat eine äquimolare Freisetzung von 24 mmol/l Bikarbonat verursacht. Die Osmolaliät dieser Lösung wird also nicht verändert, also entspricht der Messwert in vitro der Wirkung in vivo.
Enthält eine Lösung als Bikarbonat-Ersatz hingegen z. B. 5 mmol/l Malat, dann wird die Osmolalität nach dem Metabolismus von Malat um 5 mosmol/l erhöht, weil pro mol Malat zwei mol Bikarbonat freigesetzt werden.
Gemessene statt berechnete Osmolalitäten von Infusionslösungen
Prinzipiell wäre zu überlegen, die bisher genannten berechneten Werte der Osmolalität durch kryoskopische Messwerte der GPD zu ersetzen. Dagegen sprechen zwei Argumente. Erstens werden mit der gemessenen Osmolalität die in vitro (Labor) und nicht die in vivo (Patient) Werte beschrieben. Zweitens haben eigene Versuche zu folgendem, vorläufigen Ergebnis geführt: Während die mittlere Abweichung der gemessenen Osmolalität im Vergleich zur theoretischen bei den 3 klassischen Präparaten (Plasma, 0,9 % NaCl und 5 % Glukose) eine mittlere Abeichung von weniger als 1 % ergeben hat (n = 102), zeigt diese bei 5 Haes-Lösungen eine mittlere Überschätzung von fast 3 %. Diese atypische Abweichung kann vorläufig nur mit einem spezifischen "kryoskopischen Haes-Effekt" erklärt werden, weshalb die Kryoskopie vorläufig bei den kolloidalen Lösungen nur mit Vorbehalt einsetzbar ist. Es wäre wünschenswert, wenn die Hersteller dieser Lösungen valide Messwerte zur Thematik beitragen könnten. Bis dahin sollte, wegen dieser zwei Argumente, der berechneten in vivo Osmolalität der Vorzug gegeben werden.
Isotonie einer Infusionslösung
Für die optimale Information des Arztes wäre damit zu fordern, dass eine Infusionslösung mit der realen in vivo Osmolalität (mosmol/kg H2O) gekennzeichnet werden sollte, die aus der analytischen Zusammensetzung mit Wassergehalt und osmotischem Koeffizienten, wie beschrieben, berechnet werden kann. Als isoton wäre sie zu bezeichnen, wenn dieser Wert zwischen 280 und 300 mosmol/kg H2O liegt [6].
Aktuelle balancierte Lösungen
Eine Zusammenstellung aktuell eingesetzter Infusionslösungen (siehe Tabelle) zeigt, dass hypotone Lösungen relativ häufig im Markt vertreten sind. Als hypoton einzustufen sind die klassischen kristalloiden Lösungen Ringer-Laktat bzw. -Azetat sowie Jonosteril und auch so genannte balancierte HES-Lösungen (6 % HES 130) Volulyte und Vitafusal, bei deren Weiterentwicklung aus den klassischen HES-Lösungen (6 % HES 130) in 0,9 % NaCl (Voluven, VitaHes) mehr oder weniger auf die Isotonie verzichtet wurde. Auch die beiden bekannten Gelatine-Lösungen sind deutlich hypoton. Ausnahmen sind zwei isotone Lösungen, nämlich Sterofundin ISO und Tetraspan.
Fazit für die Praxis
Die Infusion größerer Volumina hypotoner Lösungen ist zu vermeiden (Intrakranieller Druck und Osmolalität von Infusionslösungen), isotonen Lösungen mit einer Osmolalität von 280 – 300 mosmol/kg H2O ist daher in jedem Fall der Vorzug zu geben. Zur besseren Information des Arztes sollte eine Infusionslösung mit der vom Hersteller berechneten, realen in vivo Osmolalität (mosmol/kg H2O) gekennzeichnet werden.
Anmerkungen zur Nomenklatur (für speziell Interessierte)
Hat eine Lösung den gleichen osmotischen Druck wie das Zellinnere, ist sie isoosmotisch und erzeugt an der nur für Wasser durchlässigen (näherungsweise semipermeablen) Zellmembran keine hydrostatische Druckdifferenz. Ist sie hypoosmotisch, verursacht sie innen eine Druckzunahme, ist sie hyperosmotisch, eine Druckabnahme. Da der osmotische Druck nicht als hydrostatische Druckänderung gemessen werden kann, wird zur Charakterisierung des osmotischen Druckes die Osmolalität verwendet. Ihre Messung erfolgt üblicherweise über die Gefrierpunktsdepression (GPD): Die beiden Bezugspunkte sind Aqua dest. (0 mosmol/kg H2O) mit einer GPD von O °C und die 1 osmolale Mannit-Lösung (1.000 mosmol/kg H2O) mit einer GPD von - 1,86 °C.
Mit der Bezeichnung Tonizität wird das funktionelle Verhalten beschrieben, d. h. ob eine Zelle in einer Lösung durch Wasseraufnahme anschwillt oder durch Wasserabgabe schrumpft. Eine Lösung ist isoton, wenn in sie eingebrachte Zellen weder schrumpfen noch schwellen, sie ist hyperton, wenn sie den Zellen Flüssigkeit entzieht und umgekehrt ist sie hypoton, wenn die Zellen in ihr schwellen.
Die hier verwendete Nomenklatur weicht hiervon etwas ab: Eine isotone Lösung wird mit der Osmolalität von 290 mosmol/kg H2O charakterisiert. Das möglicherweise unterschiedliche Verhalten der GPD-Messung im Labor wird mit "in vitro" und die Wirkung am Patienten mit "in vivo" beschrieben. Als Beispiel dafür gilt die 5 %ige Glukose-Lösung, die in vitro isoton ist (290 mosmol/kg H2O), in vivo aber wie Aqua dest. hypoton wirkt. Als weiteres Beispiel kann eine 1,74 %ige Harnstoff-Lösung genannt werden, die in vitro über die GPD mit 290 mosmol/kg H2O als isoton einzustufen ist, in vivo aber wie eine hypotone Lösung wirkt, weil Harnstoff frei permeabel (MW 60) schnell in das Zellinnere unter Mitnahme von Wasser eintritt.
Literatur
- Geigy Scientific Tables
In: Physical Chemistry (Lentner C, ed.), Vol 3, Ciba-Geigy, Basel 1984 - Glasser L, Sternglanz, PD, Combie J, Robinson A
Serum osmolality and its applicability to drug overdose
Am J Clin Path 1973; 60: 695 - 699 - Hendry EB
Osmolarity of human serum and of chemical solutions of biological importance
Clin Chem 1961; 7: 156 - 164 - Hendry EB
The osmotic pressure and chemical composition of human body fluids
Clin Chem 1962; 8: 246 - 265 - Olmstead EG, Roth DA
The relationship of serum sodium to total serum osmolarity: A method of distinguishing hyponatremic states
Am J Med Sci 1957; 233: 392 - 399 - Zander R, Adams HA, Boldt J, Hiesmayr MJ, Meier-Hellmann A, Spahn DR, Standl T
Forderungen und Erwartungen an einen optimalen Volumenersatz
Anästhesiol Intensivmed Notfall Schmerzther 2005; 40: 701 – 719
