
Auch die Mutter beeinflusst das fetale Laktat
Gastkommentar von cand. med. Maximilian Lodde (Mainz)
Einleitung
Sicherzustellen, dass ein ungeborenes Kind während seiner Geburt ausreichend mit Sauerstoff versorgt ist, ist eine der großen Herausforderungen der modernen Geburthilfe.
Aktuell stellt das Kardiotokogramm (CTG) eine sehr sensible Überwachungsmethode dar. Anhand kontinuierlicher Aufzeichnung der fetalen Herzfrequenz in Verbindung mit der mütterlichen Wehentätigkeit wird dabei der Kindszustand abgebildet. Ein Abfall der Herzfrequenz wird als kindliche Reaktion auf eine Sauerstoffunterversorgung gewertet. Dass aber nicht jede Auffälligkeit im CTG eine direkte Gefahr für das Kind darstellt, ist ein Nachteil dieser Methode.
Unter der Annahme, dass ein Sauerstoffmangel auch zu einer Ansäuerung (Azidose) des kindlichen Blutes führt, hat sich die Mikroblutuntersuchung (MBU) als Ergänzung zum CTG etabliert. Im Falle eines suspekten CTGs wird eine kleine Blutprobe am Kopf des ungeborenen Kindes entnommen und auf ihren pH-Wert und den Base Excess (BE) untersucht. Ein niedriger pH (Azidose) kann so ein pathologisches CTG bestätigen. Des weiteren erlaubt der BE eine Unterscheidung zwischen einer vermutlich harmlosen respiratorischen und einer gefährlichen metabolischen Azidose [7, 9, 12].

Der BE als (aus pH und pCO2) berechneter Wert wird zusätzlich von der Sauerstoffsättigung (sO2) der Blutprobe maßgeblich mitbestimmt. In der Geburtshilfe kann dies infolge der niedrigen sO2-Werte zu einer BE-Unterschätzung bis zu 3 mmol/l führen [10]. Damit entsteht bei der Interpretation des BE eine unnötige Unsicherheit [13]. Ein weiterer Nachteil des BE ist das relativ komplexe und zeitaufwändige Bestimmungsverfahren sowie das relativ große Probenvolumen (mindestens 50 µl). Die entsprechenden Messgeräte sind aufgrund ihrer Größe meist an einen festen Standort gebunden und somit nicht direkt am Patientenbett verfügbar.
Um diesen Unzulänglichkeiten des BE zu begegnen, wurde in der Vergangenheit von zahlreichen Autoren immer wieder die Wertigkeit der Laktatmessung zur Erkennung eines kindlichen Sauerstoffmangels überprüft [1, 2, 6]. Die Idee dabei ist, dass Laktat unter anaeroben Bedingungen als Endprodukt der Glykolyse anfällt und so ein direktes Maß der Sauerstoffunterversorgung darstellt. Laktat als venös zu entsorgender Hypoxiemarker konkurriert auf diese Weise diagnostisch mit dem Nachweis eines O2-Mangels auf der arteriellen Versorgungsseite.
Methodik
Im Zeitraum von 2006 bis 2007 wurden 299 Geburten an der Klinik für Geburtshilfe und Pränatalmedizin der Dr. Horst Schmidt-Kliniken in Wiesbaden beobachtet.
In der ersten Minute nach der Geburt des Kindes wurde der Laktat- und Säure-Basen-Status in den Nabelschnurgefäßen (Arteria und Vena umbilicalis) und zeitnah auch im mütterlichen Blut gemessen. Die Blutgasanalyse zur korrekten Berechnung des Basendefizits (negativer BE) [13] ist dabei mit den Geräten AVL Compact 3 (Diamond Diagnostics, Holliston, USA) und ABL 510 (Radiometer, Kopenhagen, Dänemark) durchgeführt worden. Mit dem neuen mobilen Messgerät Lactate Scout (SensLab, Leipzig, Deutschland) wurde parallel die jeweilige Laktatkonzentration (cLac) im Vollblut bestimmt und mit dem Hämatokrit auf Plasma umgerechnet. In einem Vergleich mehrerer Laktatmessgeräte wurde für das mit nur 0,5 µl Blut arbeitende Gerät Lactate Scout eine hohe Präzision nachgewiesen [11]. Als objektives Maß für den kindlichen Gesundheitszustand nach der Geburt wurde der von einem Arzt vergebene Apgarwert der ersten Lebensminute herangezogen.
Ergebnisse
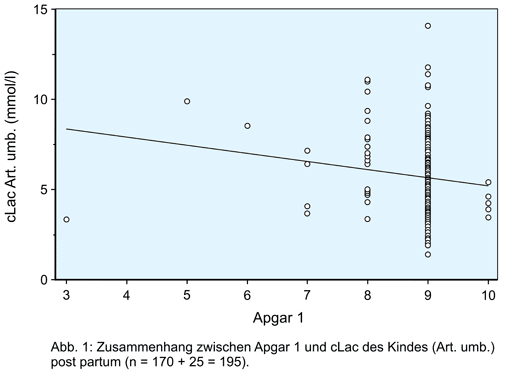
Anhand der Daten kann nachvollzogen werden, dass das BD und die cLac in der Arteria umbilicalis (Art. umbilicalis) zwar signifikant mit dem am Apgar 1 bewerteten Gesundheitszustand des Neugeborenen korrelieren (Zeile 1 und 3 in Tabelle 2; Abbildung 1). Gleichzeitig ist bei beiden Messgrößen der klinisch empfundene Unterschied zwischen Kindern mit einem hohen Apgar 1 und denjenigen mit einem niedrigen Apgar 1 jedoch sehr gering. Etwas schlechter wird das kindliche Befinden durch den Vergleich von mütterlichem und fetalem BD ausgedrückt (Zeile 4 in Tabelle 2).
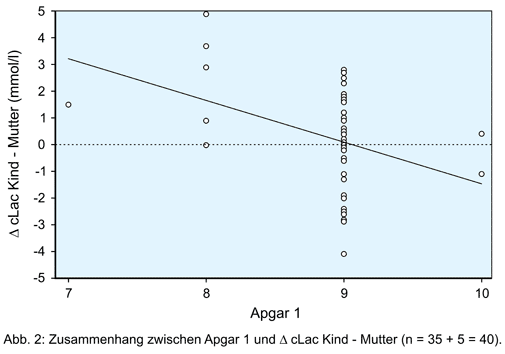
Demgegenüber bildet die Differenz aus kindlichem und mütterlichem Laktat eine sowohl signifikante als auch deutlich klinisch erkennbare Trennschärfe zwischen Kindern mit einem hohen und einem niedrigen Apgar 1 ab (Zeile 2 in Tabelle 2; Abbildung 1).
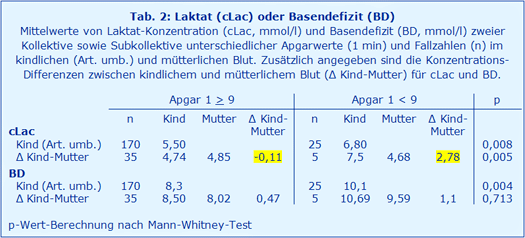
Abb. 1 und 2:
Diskussion
Bezüglich des Laktats bilden der mütterliche und der fetale Kreislauf ein offenes System. Laktat tritt vom Kreislauf mit der höheren Konzentration in denjenigen mit niedrigerer über [4, 5]. Soll also mittels der cLac in einer MBU die Diagnose fetale Hypoxie gestellt werden, muss ausgeschlossen werden, dass das gemessene Laktat Folge einer Laktazidose mütterlichen Ursprungs ist [4]. Es ist somit zu empfehlen, die cLac simultan in der MBU und bei der Mutter zu bestimmen, um den fetalen Gesundheitszustand richtig einschätzen zu können. Es ist grundsätzlich zu jedem Zeitpunkt der Geburt davon auszugehen, dass bei einer negativen Laktatdifferenz zwischen Fet und Mutter, also fetal niedriger als maternal (cLac Fet – Mutter < 0) keine Gefahr für das Kind durch Hypoxie besteht. Eine positive Laktatdifferenz hingegen, also fetal höher als maternal (cLac Fet – Mutter > 0), spricht eindeutig für eine fetale Hypoxie. Ein genauer Grenzwert im positiven Bereich ab dem eine Intervention zur Abwendung eines Hypoxieschadens des Kindes nötig wird, kann noch nicht exakt festgelegt werden. Eine weitere Studie zur Festlegung dieser Grenze findet zurzeit statt.
Das mobile Laktatmessgerät Lactate Scout bietet aufgrund seines geringen Messvolumens (0,5 µl) und seiner schnellen Auswertungszeit von 10 Sekunden sehr gute Voraussetzungen für die Laktatmessung unter der Geburt und kann direkt am Patientenbett eingesetzt werden.
Die Wertigkeit des BD zur Erkennung fetalen Distresses darf aufgrund der aktuellen Datenlage kritisch hinterfragt werden (Tabelle 2): Zwar unterscheidet sich das BD der Kinder mit einem Apgar 1 ≥ 9 gegenüber denen mit einem Apgar 1 < 9 signifikant, die kleine Differenz des BD zwischen Mutter und Kind ist allerdings für die Diagnostik kaum verwertbar [8]. Es fällt allerdings auf, dass das fetale und mütterliche BD immer deutlich höher ausfallen als das zugehörige Laktat, wie es auch bei Schockpatienten beobachtet werden kann. Nachteilig bei der Bestimmung des BD ist der messtechnische Aufwand am fixen Standort, das relativ große Probenvolumen und die langsamere Auswertung.
Fazit
- Nur eine positive Laktatdifferenz, d. h. die fetale Laktatkonzentration ist höher als die maternale, spricht eindeutig für eine fetale Hypoxie.
- Das mobile Laktatmessgerät Lactate Scout kann aufgrund seiner Genauigkeit (maximal zulässige Unpräzision < 6 %), des geringen Probenvolumens (0,5 µl) und der schnellen Auswertungszeit (10 Sekunden) zur Diagnostik unter der Geburt direkt am Patientenbett eingesetzt werden.
- Auch wenn die diagnostische Aussagekraft des BE vergleichsweise größer ist, ist die Laktat-Diagnostik in der Neonatologie dem BE doch überlegen, weil dieser einen größeren messtechnischen Aufwand und ein größeres Probenvolumen (40 – 60 µl) erfordert.
Literatur
- Allen RM, Bowling FG, Oats JJ
Determining the fetal scalp lactate level that indicates the need for intervention in labour
Aust N Z J Obstet Gynaecol 2004; 44: 549-552 - Borruto F, Comparetto C, Wegher E, Treisser A
Screening of foetal distress by assessment of umbilical cord lactate
Clin Exp Obstet Gynecol 2006; 33: 219-222 - Feige A, Rempen A, Würfel W, Jawny S, Rohde A
Diagnostik der fetalen Azidose sub partu - Therapie des geburtshilflichen Notfalls (pp. 515-520)
In: Frauenheilkunde, Urban & Fischer, München, Jena, 2006 - Kalinkov D
Klinische Bedeutung der parallelen Bestimmung von Laktat bei Mutter und Kind zum Zeitpunkt der Geburt: II. Befunde bei fetal distress und Sectio caesarea
In: Perinatale Medizin (Schmidt, E., Dudenhausen, JW, Hrsg.), Georg Thieme, Stuttgart, 1981 - Kalinkov D, Schachinger H, Buchholz R
Theoretical and practical significance of parallel assays of serum lactic acid, pH and blood gases in mothers and neonates at birth
J Perinat Med 1980; 8: 134-141 - Krüger K, Hallberg B, Blennow M, Kublickas M, Westgren M
Predictive value of fetal scalp blood lactate concentration and pH as markers of neu-rologic disability
Am J Obstet Gynecol 1999; 181: 1072-1078 - Nordstrom L, Arulkumaran S
Intrapartum fetal hypoxia and biochemical markers: a review
Obstet Gynecol Surv 1998; 53: 645-657 - Nordstrom L, Ingemarsson I, Kublickas M, Persson B, Shimojo N, Westgren M
Scalp blood lactate: a new test strip method for monitoring fetal wellbeing in labour
Br J Obstet Gynaecol 1995; 102: 894-899 - Nordstrom L, Ingemarsson I, Persson B, Shimojo N, Westgren M
Lactate in fetal scalp blood and umbilical artery blood measured during normal labor with a test strip method
Acta Obstet Gynecol Scand 1994; 73: 250-254 - Qualitest, Heft 8 (2005)
Consensus: Vereinheitlichung von Nomenklatur und Symbolen, erstellt von Firmen im Bereich POC und Test-Labor für Hämodiagnostik - Qualitest, Heft 9 (2006)
Gerätetest Mobile Laktat-Messgeräte - Suidan JS, Antoine C, Silverman F, Lustig ID, Wasserman JF, Young BK
Human maternal-fetal lactate relationships
J Perinat Med 1984: 12: 211-217 - Zander R
Correct determination of blood base excess (BE, mmol/l)
Anaesthesiol Intensivmed Notfallmed Schmerzther 1995; 30 (Suppl 1): S36-38
Danksagung
Herrn PD Dr. Markus Gonser und Herrn Dr. Dr. Andreas Klee sowie dem gesamten Kreißsaalteam der Klinik für Geburtshilfe und Pränatalmedizin der Dr. Horst Schmidt-Kliniken in Wiesbaden wird herzlich für die Unterstützung bei der Studie gedankt.
Anmerkung
Die Ergebnisse entstammen der medizinischen Dissertation von Maximilian Lodde.
