
10 Thesen zum Lyo-Eigenplasma
Lyo-Poolplasma und Lyo-Eigenplasma aus der Apherese haben Zukunft
Humanplasma als physiologischer Volumenersatz mit Gerinnungspotential wird in 10 Thesen mit aktuellen Fakten neu bewertet.
Die besonders günstige Verträglichkeit der Anämie unter Normovolämie bis zu einer cHb von 6 g/dl wird beschrieben, was auch für die simultane Dilutions-Koagulopathie gilt. Diese kritische cHb kann unter Hyperoxie weiter nach unten verschoben werden, jede dilutionsbedingte Azidose verschiebt sie nach oben und ist daher unbedingt zu vermeiden. Eine eventuell erforderliche Transfusion von EK's erfordert eine strenge Indikation, die sich vor allem an den Hypoxie-Zeichen orientiert. Im Gegensatz zu den Richtlinien der Bundesärztekammer ist Plasma ein physiologischer Volumenersatz und zugleich auch, zum richtigen Zeitpunkt eingesetzt, ein physiologisches Gerinnungspräparat.
Nur im Ausnahmefall sollte Plasma als Ausgangsprodukt für kostspielige Präparate verwendet werden. Da Lyo-Eigenplasma immer noch eine Qualitäts-Verbesserung erfahren kann und der Einsatz von Lyoplasma bereits Stand der Technik bei optimalen Lagerungsbedingungen ist, steht einer breiten Indikation von Lyo-Eigenplasma nichts mehr im Wege, sobald die Rahmenbedingungen für Lyo-Eigenplasma (Zulassung, Lagerungsort, Kosten) geklärt sind.
These 1 - Anämie unter Normothermie, Normoxie und Normovolämie
Die Anämie ist unter Normothermie und Normoxie beim kardial gesunden Patienten bis zu einer cHb von 6 g/dl sehr gut tolerabel, solange die Normovolämie gesichert ist.
Normothermie
Eine Körperkerntemperatur von 36,5 - 37 °C ist mithilfe von Wärmeverlust-Maßnahmen und Wärme-Applikations-Systemen leicht zu gewährleisten.
Normoxie
Bei normaler Lungenfunktion (Spontanatmung) oder künstlicher Beatmung kann eine weitgehend normale arterielle O2-Sättigung eingestellt und mit einem Pulsoxymeter nicht invasiv kontrolliert werden (psaO2 ≥ 92 %).
Normovolämie
Diese ist – im Gegensatz zur Isovolämie – ein größeres Problem, weil eine klinisch praktikable Messung des Blut- oder Plasma-Volumens nicht existiert.
Isovolämie
Hier wird das verloren gegangene Volumen an Blut durch ein gleiches Volumen an Plasma oder kolloidaler Lösung ersetzt, d.h. das Blutvolumen bleibt konstant.
Isovolämische Hämodilution
In diesem Falle wird bei einem Blutverlust von 90 %, d.h. einer simultanen Zufuhr von 4,5 l eines Kolloids, eine cHb von 6 g/dl (40 % des Normalwertes) erreicht.
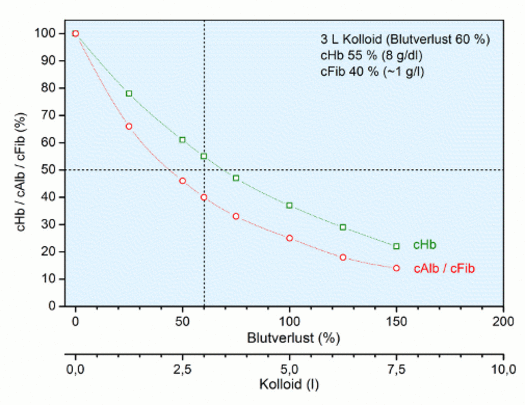
Kritische cHb
Zu dieser Frage liegen eine Vielzahl von Publikationen und Empfehlungen vor, stellvertretend für alle soll eine Arbeit von Weiskopf et al. [11] kommentiert werden, weil sie eine eindeutige isovolämische Hämodilution beschreibt:
Wenn die cHb bei 11 präoperativen Patienten und 21 Probanden unter Normoxie und Normothermie innerhalb von 2,4 Stunden durch isovolämische Dilution mit 5 % Albumin-Lösung und/oder Eigenplasma auf 5 g/dl gesenkt wurde, dann traten keinerlei Hypoxie-Zeichen auf, also Erhöhung der Laktat-Konzentration (cLact) oder des Basen-Defizits (BE). Der O2-Verbrauch stieg erwartungsgemäß um 11 % an, erwartungsgemäß, weil die Herzfrequenz um 59 % und das HZV um 87 % zunahmen. Eine sorgfältige ST-Strecken-Analyse des EKGs ergab bei nur 2 Teilnehmerinnen eine kurzzeitige, reversible harmlose Veränderung. Es erscheint also zulässig, eine klinisch praktikable kritische cHb von 6 g/dl anzunehmen, von den QLL der BÄK bis 2014 bestätigt [2].
Darüber hinaus kann festgehalten werden, dass auch extreme Anämien – vornehmlich bei Zeugen Jehovas – überlebt werden, wie gerade wieder an einem Beispiel einer Anämie mit nur 2,1 g/dl beschrieben wurde.
Kritische cHb unter Hyperoxie
Die Gabe von 100 % O2 (FIO2 1,0) erhöht den Anteil des physikalisch gelösten O2 im Blut und wirkt damit wie eine "funktionelle Transfusion von 2 EK`s" entsprechend einer ∆cHb von 1,5 g/dl. Umgekehrt bedeutet dies, dass die kritische cHb unter einer FIO2 von 1,0 nicht mehr 6,0 g/dl sondern nur noch 4,5 g/dl beträgt.
Dilutions-Koagulopathie
Da die Konzentrationen von Fibrinogen (cFib) und Albumin (cAlb) in g/l Plasma angegeben werden, nehmen diese Konzentrationen bei einer Dilution mit erythrozytenfreien Lösungen (Kolloide, Plasma) stärker ab als die cHb, die in g/dl oder g/l Blut angegeben wird. Dies ist in der Abbildung "Isovolämische Hämodilution" oben dargestellt. Die Konsequenz ist, dass bereits bei einem Blutverlust von 60 % (cHb 8 g/dl) die Dilution zu einer Abnahme der cFib auf 40 % des Normalwertes von 2,75 g/l führt, also ca. 1 g/l. Dieser Wert wird je nach Quelle als therapiebedürftiger Grenzwert angegeben, d. h. bei einem Wert von < 1,0 g/l sollte eine Fibrinogen-Therapie erwogen werden, um eine Verdünnungs-Koagulopathie gemäß Richtlinien der BÄK [2] zu verhindern.
Es ist offensichtlich, dass diese Argumentation zu vorsichtig angesetzt ist, da eine routinemäßige Fibrinogen-Therapie ab einer cHb von 8 g/dl entsprechend 1 g/l cFib unrealistisch sein dürfte. Es sei denn, zugleich liegt eine metabolische Azidose plus Hypofibrinogenämie vor, dann ändern sich die Verhältnisse.
Dilutions-Koagulopathie plus Azidose
Eine isovolämische Hämodilution bis zu einer cHb von 8 g/dl und einer cFib von ca. 1 g/l kann entweder mit einer balancierten Lösung oder mit einer nicht-balancierten Lösung erfolgen. Da eine balancierte Lösung HCO3-Vorstufen wie Azetat oder Malat enthält, wird der Säure-Basen-Status des Patienten nicht verändert, weil die Plasma-HCO3-Konzentration von 24 mmol/l und damit der BE des Patienten mit 0 mmol/l unverändert bleiben. Erfolgt die Dilution hingegen mit einer nicht-balancierten Lösung, die diese Substanzen nicht enthält (z.B. 0,9 % NaCl oder 5 % Albumin in 0,9 % NaCl), wird die Plasma-HCO3-Konzentration, wie auch das Fibrinogen auf 40 % gesenkt, also auf 9,6 mmol/l, was einem BE von -21 mmol/l entspricht, einer massiven, nicht respiratorischen Azidose. Diese Azidose gilt es zu verhindern, damit es nicht blutet.
Für Trauma-Patienten gilt: Eine metabolische Azidose kann ursächlich das Blutungs-Risiko erhöhen, schon beim BE von -15 mmol/l ist die Gerinnungsaktivität in vitro und in vivo auf ca. 50 % gesenkt, die Mortalität von Polytrauma-Patienten beträgt dann ca. 50 %.
Hypovolämie
Symptome einer Hypovolämie sind neben den hämodynamischen Größen (Anstieg der Herzfrequenz, Abnahme des MAP) die Symptome einer Hypoxie:
Neben einer ST-Strecken-Veränderung im EKG (myokardiale Hypoxie) ein Anstieg des Basen-Defizits (neg. BE > 3 mmol/l) oder der Lactat-Konzentration (clact > 3 mmol/l), insbesondere dann, wenn das Basen-Defizit oder die cLact weiter ansteigen (periphere, nicht lokalisierte Hypoxie).
Hypovolämie-Nachweis
Zur Prüfung einer Hypovolämie (CVP << 5 mmHg) kann ein Kolloid-Bolus von 500 ml so oft appliziert werden, bis ein CVP-Anstieg von 3 mmHg provoziert wird.
Hinweis: Hierbei handelt es sich um eine Änderung des ZVD (CVP), also eine dynamische Größe, nicht um die statische Größe ZVD, die zur Diagnostik eines Volumenmangels abgelehnt wird [9].
These 2 - Transfusion von Erythrozyten (EK's), strenge Indikation
Hypoxie-Zeichen
Die Transfusion von EK's setzt die Existenz von Hypoxie-Zeichen voraus, sei es als myokardiale Hypoxie (ST-Strecken-Veränderung, EKG), als cerebrale Hypoxie (Abnahme der mittleren cerebralen O2-Sättiung, rsO2 (%) über NIRS) oder als periphere, nicht lokalisierte Hypoxie mit Anstieg des Basen-Defizits (neg. BE > 3 mmol/l) oder der Lactat-Konzentration (clact > 3 mmol/l), insbesondere dann, wenn diese Zeichen (EKG, NIRS, BE, cLakt) persistieren oder weiter ansteigen.
Nachweis von Hypoxie-Zeichen
Zum Nachweis von Hypoxie-Zeichen kann die Hyperoxie eingesetzt werden: Über eine kurzfristig eingestellte FIO2 von 1,0 wird geprüft, ob die "funktionelle Transfusion von 2 EK's" (s. o.) entsprechend einer cHb-Zunahme von 1,5 g/dl, die Gabe von EK's – objektiv – indiziert, d.h. ob die EKG-Veränderungen verschwinden bzw. die rsO2 erwartungsgemäß ansteigt oder nicht. Auf diesem Wege kann ein myokardialer oder cerebraler O2-Mangel schnell und objektiv diagnostiziert werden.
These 3 - Plasma ein physiologischer Volumenersatz
Plasma als physiologischer Volumenersatz ist eine logische Einordnung, nicht so in den Leitlinien der Bundesärztekammer (LL BÄK) und ab 2008 Querschnittsleitlinien (QLL BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten.
Schon 2001 heißt es dort: „Die Gabe von GFP ist nicht angezeigt als Volumenersatztherapie.“ Und dann zusätzlich: … auch nicht „als "Ersatz" von Gerinnungsfaktoren allein aufgrund erniedrigter Gerinnungsparameter im Laboratorium ohne Zeichen einer klinisch manifesten Blutungsneigung oder akuter Blutungen“ mit dem Zusatz „Cave: Volumenüberlastung.“
Diese Einstufung bleibt auch bis zu den QLL der BÄK (2014) [2] erhalten: Unter der Überschrift fehlende Indikationen für die Therapie mit Plasma werden Zustandsbilder aufgelistet, bei denen Plasma nicht angewendet werden sollte: Primärer Volumenersatz (Beurteilung mit 1 C+, d. h. „Keine randomisierten kontrollierten Studien, jedoch eindeutige Datenlage“. Eine Begründung für diese Einstufung wird – ungewöhnlich – nicht gegeben.
Diese nicht nachvollziehbare Einstufung wird dann allerdings sehr fragwürdig, wenn es um die Beurteilung von Eigenplasma als Volumenersatz geht:
LL BÄK 2001: „Bei langfristig planbaren Operationen mit absehbar großem Blutverlust ... ist die präoperative Gewinnung mehrerer Einheiten autologes gefrorenes Frischplasma mittels Plasmapherese eine gute Möglichkeit, perioperativ ... einen physiologischen Volumenersatz auch bei Verlust großer Mengen durchzuführen.
LL BÄK 2003: Hier heißt es im ansonsten gleichen Absatz plötzlich ... einen "physiologischen" Volumenersatz auch bei Verlust großer Mengen ..., also physiologisch in Anführungszeichen.
QLL BÄK 2008 / 2011: Jetzt heißt es an gleicher Stelle einen "autologen" Volumenersatz auch bei Verlust großer Mengen ...
QLL BÄK 2014: Die gleiche Formulierung gilt noch immer.
Also eine wundersame Wandlung von Eigenplasma als physiologischem Volumenersatz, über "physiologischem" Volumenersatz zum "autologen" Volumenersatz. Und dies alles – ohne jegliche Begründung – durch die Mitglieder des ständigen Arbeitskreises.
Somit bleibt festzuhalten, dass die QLL der BÄK hier bis 2014 [2] keine nachvollziehbare Beurteilung liefern. Diese "akademische Verwirrung" soll mit einem besonderen Zitat belegt werden: „FFP bietet einen guten Volumeneffekt, sollte aber nicht dafür eingesetzt werden“ [6].
Dass die Richtlinien zum "richtigen" Einsatz von FFP auch in anderen Ländern Probleme bereiten, wird schon seit längerem kritisch beobachtet, insbesondere deshalb, weil der klinische Einsatz von FFP national und international laufend zunimmt [9]. Daher gilt bis zum Beweis des Gegenteils: Plasma, und damit auch Eigenplasma, ist ein physiologischer Volumenersatz.
These 4 - Plasma, ein physiologisches Gerinnungspräparat
Plasma ist ein physiologisches Gerinnungspräparat, sofern es rechtzeitig eingesetzt wird.
Wird Plasma zu spät eingesetzt, kann es nicht mehr als Gerinnungspräparat verwendet werden, wie in den QLL der BÄK von 2014 [2] richtig beschrieben:
Wenn bei einer Verdünnungs-Koagulopathie infolge schwerem akutem Blutverlust bereits das 1-fache des zirkulierenden Blutvolumens infundiert wurde, ist mit einem als kritisch angesehenen Abfall der Fibrinogen-Konzentration unter 1 g/l oder des Quickwertes unter 50 % zu rechnen. Unterhalb dieser Grenzwerte sind mikrovaskuläre Blutungen zu befürchten.
Beispiel: Bei einem Patient (KG 75 kg) mit einem Quickwert von 40 % und dem Zielwert von 60 % wäre eine Plasma-Dosis von 1.500 ml zu fordern (20 ml/kg) entsprechend 6 Einheiten FFP zu 250 ml. Insbesondere bei eingeschränkter Nierenfunktion, schweren Lebererkrankungen oder kardiopulmonaler Insuffizienz ist die Plasmadosis wegen der Gefahr der Hypervolämie schnell limitiert.
Wird hingegen die Indikation zur Plasma-Transfusion bei massivem, anhaltendem Blutverlust frühzeitig gestellt, ist diese Gefahr nicht mehr gegeben. Bei raschem Blutverlust sind Normovolämie und eine Hämoglobin-Konzentration von bis zu 60 g/l leicht aufrechtzuerhalten, wenn die Plasma-Transfusion frühzeitig begonnen wird. Zusätzlich wird eine durch falsche Wahl von kristalloiden und kolloidalen Volumenersatzmitteln erzeugte Azidose vermieden (s. u.).
Ziel der Behandlung ist das Sistieren bzw. die Verhütung von mikrovaskulären Blutungen durch Sicherstellung eines Quickwertes von mindestens 50 %, der Fibrinogen-Konzentration von mindestens 1 g/l und damit Verkürzung der APTT auf Werte < 45 s.
Als Resultat gilt es festzuhalten: Das Cave "Volumenbelastung" gilt nicht, wird Plasma frühzeitig als Volumenersatz mit Gerinnungsfaktoren eingesetzt.
Für das hier besprochene Lyo-Plasma kann festgehalten werden, dass die Aktivität der Gerinnungsfaktoren zwischen 0 und 20 - 25 % (FVIII, vWF) abnimmt [1], Lagerung bei Raumtemperatur, also vergleichbar mit dem herkömmlichen FFP, bei dem durch Dilution, Einfrieren und Auftauen 5 - 15 % der Aktivität verloren gehen.
These 5 - Plasma, Ausgangsprodukt für kostspielige Präparate im Ausnahmefall
In zunehmendem Maße wird das "kostbare" Plasma dem Markt entzogen, um daraus hochpreisige Präparate herzustellen. Hier ein Beispiel:
CSL Plasma (www.cslplasma.de): Das Unternehmen betreibt bundesweit acht Plasmacenter, in denen freiwillige Spender Blutplasma spenden können. Blutplasma ist die Grundlage vieler lebensrettender Medikamente wie Gerinnungs- und Immunglobulinpräparate. Das gespendete Plasma wird von CSL Plasma nach medizintechnischer Prüfung an die CSL Behring-Produktionsstandorte z.B. in Marburg weiter gegeben.
Eine solche Plasmaspende erfolgt „auf keinen Fall umsonst“, hier eine kleine Auswahl (Zitate) aus den „10 guten Gründen“:
- Du machst einem kranken Menschen ein tolles Geschenk, das dich nichts kostet.
- Du beweist Menschlichkeit und lernst bei der Spende viele nette Menschen kennen, die sich wie du sozial engagieren.
- ...
- Das Pflaster an deinem Arm lässt jeden wissen, wie tapfer du warst – es ist deine persönliche Auszeichnung, die du solange tragen kannst, wie du möchtest.
- Als Plasmaspender erhältst du Bonuspunkte bei immer mehr Krankenkassen.
- ...
- ...
- ...
- Du kannst dir, während du anderen hilfst, selbst etwas Gutes tun und es dir bei der Spende bequem machen, ein Buch lesen oder Musik hören.
- Du bist ein Lebensretter.
Kommentar zu den Bonuspunkten bei Krankenkassen: Tatsächlich vergeben einige Krankenkassen Bonuspunkte nicht nur für die Blut- sondern auch für die Plasmaspende. Wenn man diese Bonuspunkte hingegen für jedes Lyo-Eigenplasma an den Eigenspender vergeben würde, wären diese vermutlich sinnvoller angelegt als für den Spender, der zugunsten von CSL spendet, „die klare Nummer eins der Welt der Blutplasmahersteller mit ihren zweistellig wachsenden Gewinnen“ (FOCUS-MONEY: 17.09.2008).
Nachtrag:
Unter 10 gute Gründe ist immer noch aufgeführt (02.08.2015):
5. Als Plasmaspender erhältst du Bonuspunkte bei immer mehr Krankenkassen.
Diese Aussage trifft nicht zu:
Von den beiden, von CSL Plasma genannten Krankenkassen, hat zur Zeit nur die Barmer die erwähnten Bonuspunkte (noch) im Programm.
Die IKK classic „hat die Blut- und Plasmaspende als bonusfähige Maßnahmen vor ca. 1 Jahr aus dem Bonusprogramm wieder entfernt…“
Eine erneute Nachfrage bei CSL Plasma nach weiteren Krankenkassen bleibt unbeantwortet:
Fazit: Bei den 10 guten Gründen muss es somit heißen:
5. Als Plasmaspender erhältst du Bonuspunkte bei einer Krankenkasse.
Die aus gespendetem Poolplasma gewonnenen, hochpreisigen Präparate sind z.B. Human-Albumin, Fibrinogen und PPSB (Prothrombin, Proconvertin, Stuart-Faktor und antihämophiler Faktor B).
Am Beispiel von Albumin versus FFP soll diese paradoxe Situation demonstriert werden:
- Aus dem gespendeten Plasma wird Human-Albumin gewonnen, in einer Konzentration von 50 g/l hergestellt (quasi isoonkotisch in 0,9 % NaCl, also nicht balanciert) und als fragliche Volumenersatz-Lösung angeboten. Diese kostet dann als 250 ml Lösung ca. 75 - 85 € (Vorteil: Lagerung bei Raumtemperatur, Haltbarkeit 5 Jahre)
[Preise (€) im Internet am 15.06.15: Alburex 5 (CSL Behring) 74,34 (1/2 von 500 ml); Albiomin 5 % (Biotest) 76,74; Human Albumin 50 g/l (Baxter) 77,99; Humanalbin (CSL Behring) 78,61 (1/4 von 1000 ml); Human Albumin 5 % (Grifols) 82,10; Albunorm 5 % (Octapharma) 86,50].
Zum Vergleich: Die gleiche Menge gefrorenes Frischplasma (FFP), also vollwertiges Plasma incl. Gerinnungspotential (isoonkotisch, isoton, isoelektrolytisch etc.) (Nachteile tiefgefroren, 2 Jahre Haltbarkeit), kostet – je nach Einkaufsort – zwischen 45 und 63 € pro 250 ml Beutel, also nur ca. 2/3 eines nicht balancierten Albumin-Präparates. Ergibt dies einen Sinn? - „So sind im Jahr 2013 nach Angaben des Paul-Ehrlich-Instituts (Langen) 16.834 kg Humanalbumin in Deutschland verbraucht worden“ [3].
Das entspricht, unter der Annahme, dass hiervon 90 % für einen isoonkotischen Volumenersatz verwendet wurden, ca. 300.000 Liter 5 % Albumin-Lösung. Damit stehen 275.000 Liter FFP [10] ca. 300.000 Liter Albumin-Lösung [3] gegenüber. - Von den im Jahre 2011 in Deutschland verbrauchten 3.275.000 Liter Plasma wurden nur 8 % für FFP (275.000 l) verwendet, der Rest zur Produktion von Gerinnungsfaktoren, -inhibitoren und Albumin, davon stammten > 60 % aus der Apherese [10].
Fazit
Dem Markt wird "kostbares" Plasma bis ca. 90 % entzogen und für die industrielle Produktion von hochpreisigen Präparaten verwendet.
These 6 - Qualitäts-Verbesserung von Plasma bzw. Eigenplasma ist möglich
Die Qualität von Plasma und insbesondere Eigenplasma kann wie folgt verbessert werden.
Plasma-Präparate aus der Blutspende und der Apherese sind beide stark hypernatriämisch, leicht hypochlorämisch, stark alkalisierend und in vivo – nach Metabolisierung von Citrat – hyperosmolal. Beide haben die zusätzlichen Nachteile, dass sie Glukose und Phosphat enthalten, die ursprünglich nur für die Erythrozyten-Lagerung gedacht waren.
Praktisch alle erwähnten Nachteile herkömmlicher Plasma-Präparationen könnten umgangen werden, wenn bei der Apherese statt Natrium-Citrat ein neues Arginin-Citrat eingesetzt würde (CitrISO).
Dann hätte das Plasma aus der Apherese einen quasi physiologischen Säure-Basen-Status (BEpot 0 mmol/l, HCO3 24 mmol/l) mit normaler Laktat- und Glukose-Konzentration und hätte eine fast normale Natrium- und Chlorid-Konzentrationen bei normaler Osmolalität (288 mosmol/kg H2O).
These 7 - Einsatz von Lyo-Poolplasma ist Stand der Technik
Von 2007 bis 2011 wurden mehr als 230.000 Einheiten Lyo-Poolplasma – ohne jegliche Meldungen über klinische Nachteile – vom Deutschen Roten Kreuz West ausgeliefert [1]. Der DRK Blutspendedienst West - Zentralbereich Plasma (Hagen) hat zusätzlich folgende Messwerte aus dem Jahre 2008 zur Verfügung gestellt: Gemessene Osmolalität 300,6 mosmol/kg H2O (SD ± 3,8; n = 576).
Im Vergleich zu einer 5 %igen Albumin-Lösung beträgt der Preis für Lyo-Poolplasma heute (noch) ca. 100 € für 200 ml, also ca. 20 % mehr für ein vergleichbares (Lagerung, Haltbarkeit) Präparat, aber erneut (s .o.) ein isoonkotisches, isotones, isoelektrolytisches etc. Plasma incl. Gerinnungspotential statt einer 5 %igen nicht balancierten Albumin-Lösung.
These 8 - Lagerungs-Eigenschaften von Lyo-Eigenplasma sind optimal
Im Vergleich zu FFP mit seiner Lagerung bei -25 °C und anschließendem Auftauen stellt die Lagerung von Lyo-Eigenplasma bei +4 ° bis +25 °C (QLL BÄK) einen erheblichen Vorteil dar.
Die Verpackung sollte wie folgt optimiert werden: Zusätzlich zur Lagerung im Transfusionsbeutel wird dieser von einer luftdicht (wasserdampfdichten) abgeschlossenen (verschweißten) Alu-Hülle umgeben, auf deren Außenseite die Daten zur Kennzeichnung, zum Beispiel als vergrößerte Kopie des Personalausweises, angebracht werden. Die Änderung der Haltbarkeit von derzeit 2 Jahren [1] auf 10 Jahre oder mehr erscheint realistisch, insbesondere unter Verwendung einer zusätzlichen Aluminium-Verpackung.
Die Lyophilisation (Gefriertrocknung) ist der Natur nachempfunden:
Der Entzug von Wasser, hier in Form von Wasserdampf unter Vakuum aus gefrorenen Proben, macht die entsprechenden Materialien extrem lange lagerfähig, Saatgut (Samen) kann noch nach vielen Jahren in die Erde eingebracht werden, Trocknen und Dörren sind passive Methoden, bei denen das Wasser aus Lebensmitteln durch Verdunstung entweicht (Aufhängen von Fischen in der Sonne), bei einem Feuchtgehalt < 15 % ist Getreide bei 5 - 20 °C unbegrenzt haltbar.
These 9 - Rahmenbedingungen für Lyo-Eigenplasma sind zu klären
Das Präparat darf aufgrund seiner eindeutigen Kennzeichnung als Lyo-Eigenplasma nur dem Spender selbst transfundiert werden. In Analogie zu den QLL der BÄK gilt, dass die Weitergabe von nicht benötigtem Lyo-Eigenplasma an andere Patienten untersagt ist (10.1.1.1.). Das Präparat ist mit den Patientendaten (Name, Vorname, Geburtsdatum) sowie Entnahmedatum und -zeit zu versehen (Analogie zu 10.1.1.2. der QLL BÄK). Die Außenverpackung trägt zusätzlich die vergrößerte Kopie des Personalausweises (mit Bild). Infolge der eindeutigen Kennzeichnung als Lyo-Eigenplasma kann auf die übliche Diagnostik einschließlich AB0-Identitätstest verzichtet werden (Analogie zu 10.1.1.2. der QLL BÄK). Wer der Kostenträger für die Herstellung und Lagerung dieses Präparates ist, bleibt zu klären. Dies gilt auch für den Ort der Präparate-Lagerung.
Die erforderliche Zulassung durch das Paul Ehrlich-Institut dürfte leicht zu erhalten sein, weil die kommerzielle Plasma-Spende, die Eigenplasma-Spende und der Einsatz von Lyo-Poolplasma bereits zugelassen sind.
These 10 - Indikation von Lyo-Eigenplasma
Immer dann, wenn eine stärkere Blutung zu befürchten oder zu erwarten ist, könnte Lyo-Eigenplasma indiziert sein:
- beim Polytrauma nach Ankunft in der Klinik
- bei einer Massivblutung
- bei elektiven Eingriffen mit erwartetem hohen Blutverlust.
Der Einsatz sollte spätestens ab einer cHb von 8 g/dl erfolgen, weil jetzt schon 60 % des Blutvolumens mit Infusionslösungen simultan mit dem Blutverlust ersetzt worden sind. Bei dieser cHb beträgt die cFib noch ca. 1 g/l, d. h. sie sollte nicht wesentlich weiter gesenkt werden.
Bis zu diesem Punkt ist die permissive Hämodilution in jedem Falle tolerabel, vorausgesetzt, die Dilution erfolgt mit einer kolloidalen, balancierten Volumenersatz-Lösung (BEpot = 0 ± 10 mmol/l) einschließlich physiologischer Ca-Konzentration.
Der normovolämische Volumenersatz mit Gerinnungspotential mit dem Lyo-Eigenplasma kann nun bis zu einer cHb von 5 - 6 g/dl erfolgen, bevor mit einer Hämotherapie begonnen wird. Die Prüfung der Indikation zur Gabe von EK's erfolgt nach der Hypoxie-Prüfung mit der FIO2 von 1,0 (s. o.).
Falls vorhanden, werden möglichst frische EK's eingesetzt, weil deren Basen-Defizit noch nicht so stark zugenommen hat und die Ca-bindende Laktat-Konzentration noch relativ klein ausfällt.
Danach weisen frische EK's ein Basen-Defizit von 20 und nach 42 Tagen Lagerung ein solches von 50 mmol/l auf. Durch diese Vorsichtsmaßnahme soll eine transfusionsbedingte Azidose-Bildung verhindert werden, die die Gerinnung negativ beeinflussen würde (s. o.).
Steht kein optimiertes Lyo-Eigenplasma zur Verfügung, sondern nur das herkömmliche FFP mit seinen stark alkalisierenden Eigenschaften, also BEpot von +42 (Apherese) bis +60 mmol/l (Blutspende), dann empfiehlt sich für die Transfusion ein EK zu FFP-Verhältnis von mindestens 1 : 1, wie von Maegele et al. 2008 [7] eindrucksvoll demonstriert und in der folgenden Abbildung wiedergegeben.

Nach der Fertigstellung dieses Beitrages im Juli 2015 wurde ein Kommentar von Dudaryk und Pittet [13] vom Juni 2015 zu einer Arbeit von Holcomb et al. [12] bekannt, aus denen folgende Zitate entnommen wurden:
„Although underpowered to detect a mortality difference, i.e. „1:1:1 group vs 1:1:2 group 12.7 % vs 17.0 % at 24 hours and 22.4 % vs 26.1 % at 30 days” [12], the PROPPR trial has demonstrated that a 1:1:1 transfusion strategy achieves better early hemostasis and reduces coagulopathy compared to a 1:1:2 approach. The early administration of plasma has been shown to be beneficial apart from consideration of transfusion ratio. Perhaps more importantly, the incidence of death due to exsanguination was significantly decreased in the 1:1:1 group (9.2 %) versus the 1:1:2 group (14.6 %)” [13].
Besondere Kollektive für den Einsatz von Lyo-Eigenplasma wären logischerweise einmal das Militär (Bundeswehr) und andererseits die Glaubensgemeinschaft der Zeugen Jehovas. Beide Institutionen haben leider auf entsprechende Vorstellungen dieses Konzeptes (bisher) aus verständlicherweise unterschiedlichen Gründen noch nicht positiv reagiert.
Das Militär außerhalb von Deutschland stuft dies offensichtlich anders ein:
Das israelische Verteidigungsministerium empfiehlt Lyo-Plasma aus der Einzelspende als Volumenersatz schon am Ort der Verletzung [4] und der erste Bericht über den Einsatz von rekonstituiertem Einzelspender-Lyoplasma als Reanimations-Lösung wurde 2013 publiziert [5].
Auch Privatpersonen zunehmenden Alters und elektiven Eingriffen dürften ein gesteigertes Interesse an diesen Präparaten entwickeln.
Zusammenfassung
- Die besonders günstige Verträglichkeit der normothermen, normoxischen Anämie beim kardial gesunden Patienten ist expressis verbis unter Normovolämie bis zu einer cHb von 6 g/dl gegeben, was auch für die simultane Dilutions-Koagulopathie gilt.
- Diese kritische cHb kann unter Hyperoxie weiter nach unten verschoben werden, jede dilutionsbedingte Azidose verschiebt sie nach oben und ist folglich unter Verwendung balancierter Infusionslösungen unbedingt zu vermeiden.
- Eine eventuell erforderliche Transfusion von EK's erfordert eine strenge Indikation, die sich vor allem an den Hypoxie-Zeichen des Herzens (EKG) und des Gehirns (cerebrale sO2) sowie systemischen Zeichen (BE, Lactat) orientiert. Diese können objektiv über einen Hyperoxie-Test (FIO2 1,0) geprüft werden.
- Im Gegensatz zu den widersprüchlichen Richtlinien der Bundesärztekammer ist Plasma der ideale physiologische Volumenersatz und zugleich auch, zum richtigen Zeitpunkt eingesetzt, ein physiologisches Gerinnungspräparat, dessen Faktoren-Aktivität nur zwischen 0 und 25 % je nach Faktor abnimmt. Daher gilt bis zum Beweis des Gegenteils: Plasma und insbesondere Eigenplasma, ist ein physiologischer Volumenersatz mit starkem Gerinnungspotential.
- Human-Plasma sollte nicht mehr überwiegend sondern nur noch im Ausnahmefall als Ausgangsprodukt für hochpreisige Präparate verwendet werden.
- Lyo-Eigenplasma kann immer noch eine Qualitäts-Verbesserung erfahren:
Aus der Apherese gewonnen hat es einen quasi physiologischen Säure-Basen-Status (BEpot 0 mmol/l, HCO3 24 mmol/l) mit normaler Laktat- und Glukose-Konzentration und eine fast normale Natrium- und Chlorid-Konzentrationen bei normaler Osmolalität (288 mosmol/kg H2O). - Mit mehr als 230.000 Einheiten Lyo-Poolplasma hat das Deutschen Roten Kreuz West – ohne jegliche Meldungen über klinische Nachteile – in den Jahren 2007 bis 2011 belegt, dass Lyoplasma eine sinnvolle Alternative zum FFP und insbesondere zur 5%igen Albumin-Lösung ist, dies auch unter Kosten-Gesichtspunkten.
- Somit steht einer breiten Indikation von Lyo-Eigenplasma nichts mehr im Wege, sobald die Rahmenbedingungen für Lyo-Eigenplasma (Lagerungsort, Kosten) geklärt sind.
- Die erforderliche Zulassung durch das Paul Ehrlich-Institut sollte leicht zu erhalten sein, weil die Bausteine des Verfahrens, Plasma-Spende, die Eigenplasma-Spende und der Einsatz von Lyo-Poolplasma bereits Stand der Technik sind.
- Humanplasma als physiologischer Volumenersatz mit Gerinnungspotential ist das Präparat der Zukunft, als Lyo-Poolplasma oder insbesondere Lyo-Eigenplasma aus der Apherese.
Anhang - Herstellung von Lyo-Eigenplasma in 7 Schritten
1. Blutabnahme (Einzelspende hier, oder Apherese, nicht dargestellt)

2. Zentrifugation (Gewinnung von Plasma,
Entfernung der Erythrocyten)

3. Lyophilisation (Entzug von Wasser)

4. Versiegelung im Alu-Beutel (nicht dargestellt),
Kennzeichnung mit dem Bild des Personalausweises

5. Lagerung bei Raumtemperatur ( 5 - 25 °C)

6. Restitution (Auffüllen mit Aqua dest.)
7. Transfusion von Lyo-Eigenplasma
Die Abbildungen verdanken wir Lukas Baner (Biological and Pre-Medical Illustration, Iowa State University, USA).
Literatur
- Bux J, Dickhörner D, Scheel E
Quality of freeze-dried (lyophilized) quarantined single-donor plasma
Transfusion 2013; 53: 3203 - 3209 - BÄK: Querschnitts-Leitlinien zur Therapie mit Blutkomponenten und Plasmaderivaten, 4. überarbeitete und aktualisierte Auflage 2014
Deutscher Ärzte-Verlag, Köln, 2014 - BÄK: Therapie mit Humanalbumin - Aktualisierte Querschnitts-Leitlinien.
Deutsches Ärzteblatt 2015; 112: Heft 6 - Glassberg E, Nadler R, Gendler S, Abramovich A, Spinella PC, Gerhardt RT, Holcomb JB, Kreiss Y
Freeze-dried plasma at the point of injury: from concept to doctrine
Shock 2013; 40: 444 - 450 - Glassberg E, Nadler R, Rasmussen TE, Abramovich A, Erlich T, Blackbourne LH, Kreiss Y
Point-of-injury use of reconstituted freeze dried plasma as a resuscitative fluid: a special report for prehospital trauma care
J Trauma Acute Care Surg 2013; 75 (Suppl 2): S111 - 114 - Heindl B
Evidenzbasierte Therapie mit FFP und Faktorenkonzentraten
Präsentation DIVI 2012 - Maegele M, Lefering R, Paffrath T, Tjardes T, Simanski C, Bouillon B; Working Group on Polytrauma of the German Society of Trauma Surgery (DGU)
Red-blood-cell to plasma ratios transfused during massive transfusion are associated with mortality in severe multiple injury: a retrospective analysis from the Trauma Registry of the Deutsche Gesellschaft für Unfallchirurgie
Vox Sang 2008; 95: 112 - 119 - Marx G, Schindler AW
Intravasale Volumentherapie (Leserbrief)
Anaesthesist 2015; 64: 71 - Iorio A, Basileo M, Marchesini E, Materazzi M, Marchesi M, Esposito A, Palazzesi GP, Pellegrini L, Pasqua BL, Rocchetti L, Silvani CM
The good use of plasma. A critical analysis of five international guidelines
Blood Transfus 2008; 6: 18 - 24 - Paul-Ehrlich-Institut
Bericht nach § 21 Transfusionsgesetz. Langen 2011 [zitiert nach 6] - Weiskopf RB, Viele MK, Feiner J, Kelley S, Lieberman J, Noorani M, Leung JM, Fisher DM, Murray WR, Toy P, Moore MA
Human cardiovascular and metabolic response to acute, severe isovolemic anemia
JAMA 1998; 279: 217 - 221 - Holcomb JB, Tilley BC, Baraniuk S, et al.; for the PROPPR Study Group
Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial
JAMA 2015; 313: 471 - 482 - Dudaryk R, Pittet J-F
A ‘proppr’ answer to the transfusion ration dilemma
Anesthesiology 2015; 79: 18 - 19
