
Größere Blutung - Azidose verhindern!
Volumen- und Hämotherapie
Die größere Blutung bis zur Massivblutung, insbesondere beim Trauma- oder Polytrauma-Patienten, gilt als extremes Ereignis mit hoher Mortalität.
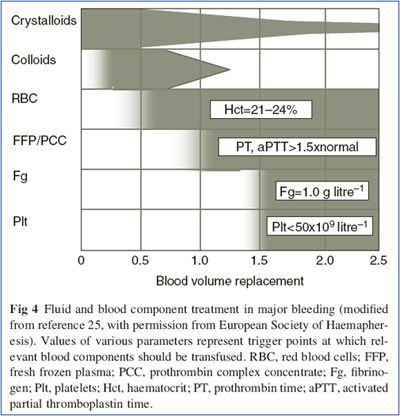
Das zur Zeit akzeptierte Schema zur Volumen- bzw. Blutkomponenten-Therapie (Fig 4, Spahn DR und Rossaint R, BJA 2005; 95: 130-139) ist dringend revisionsbedürftig: Nicht zuerst Kristalloide, dann Kolloide, dann Erythrozyten-Konzentrate (EK‘s) und dann Plasma (FFP), sondern zuerst balancierte Kolloide, dann Plasma (Volumen, Gerinnungs-Faktoren, Azidose-Prävention) und erst dann frische EK‘s, wenn die cHb unter 5-7 g/dl fällt.
Welche Bedeutung hat die Azidose bei größerer Blutung?
- Bei 8.000 Polytrauma-Patienten (4 Studien) prognostiziert ein Basen-Defizit (BD, neg. BE) von 15 mmol/l bei Krankenhaus-Aufnahme eine spätere Mortalität von ca. 50 %, vergleichbar mit 3.300 Trauma-Patienten mit stumpfem Trauma oder Schusswunde.
- Die beiden wichtigsten, vom Arzt beeinflussbaren prädiktiven Faktoren der späteren Mortalität, nämlich BD und Quick-Wert, zeigen neben Alter, ISS (Injury Severity Score), GCS (Glasgow Coma Score) und Verletzungsmuster (Kopf und Extremitäten) bei 4.000 Polytrauma-Patienten einen hochsignifikanten Zusammenhang, beim BD von ca. 15 mmol/l beträgt der Quick-Wert nur noch ca. 50 %.
- Trauma-Patienten mit Massiv-Transfusion entwickeln je nach der Höhe des BD eine Coagulopathie, Überlebende und Verstorbene können allein nach ihrem BD differenziert werden, ein BD von ca. 20 mmol/l limitiert das Überleben.
- Die Gerinnungsaktivität wird in vitro stark vom pH bestimmt, beim pH von 7,20 (Basendefizit 12,5 mmol/l) wurde eine Halbierung und beim pH von 7,60 (Basen-überschuss 16,5 mmol/l) eine Verdoppelung belegt.
- Coagulopathie, metabolische Azidose und Hypothermie gelten heute zu Recht beim Patienten als „letale Trias“.
- Im Gegensatz zu in vitro-Befunden ist aus 4 Tierversuchs-Studien zu schließen, dass die Coagulopathie trotz erfolgter Azidose-Therapie für weitere 12-18 h persistiert.
- Also muss jede Azidose unter der Therapie einer Blutung verhindert werden.
Was sind die Ursachen dieser Azidosen?
- Der hämorrhagische Schock führt infolge des Blutverlustes per se zur hypoxisch bedingten, metabolischen Azidose mit Anstieg von BD und Laktat-Konzentration.
- Bisher verfügbare Volumenersatzlösungen mussten die bestehende Azidose über eine Infusions- und Dilutions-Azidose zwangsläufig verstärken.
- Die Herstellung und Lagerung von EK‘s führt dazu, dass frische EK‘s ein BD von 20 mmol/l und 20 Tage alte EK‘s ein BD von 40 mmol/l haben. Plasma (FFP) hingegen wirkt stark alkalisierend wegen seiner hohen Citrat-Konzentration.
- Das mittlere Alter von EK‘s beträgt zum Zeitpunkt der Transfusion weltweit einheitlich ca. 20 Tage. Somit werden dem Patienten bei einer Massivtransfusion von nur 3 EK‘s (ca. 1 l) 40 mmol H+-Ionen zugeführt, etwa der Betrag, den die Niere normalerweise pro Tag zu eliminieren hat (50 mmol).
- Eine Massiv-Transfusion verursacht eine metabolische Azidose mit Coagulopathie, allein die Anzahl transfundierter EK‘s hat einen Einfluss auf die Mortalität (8.500 Patienten aus 3 Studien), ebenso eindeutig das Alter transfundierter EK’s.
Welche Konsequenzen ergeben sich für die Diagnostik, insbesondere POC?
Die Zusammenhänge zwischen Säure-Basen-Status und Gerinnung bzw. Fibrinolyse sind auf die Diagnostik auszudehnen.
- Am Beispiel einer Hypothermie, d. h. gesenkter Patienten-Temperatur, soll der Stand der Technik beschrieben werden: Ein Patient mit 32 statt 37 °C hat allein wegen der Hypothermie eine um ca. 50 % reduzierte Gerinnungsfunktion. Würde die Gerinnungs-Diagnostik z. B. mit einem Thrombelastogramm (TEG) bei 37 °C vorgenommen, würde eine Fehldiagnose produziert, weil die Blutprobe des hypothermen Patienten, im Gerät auf Normaltemperatur zurückgeführt, einen normalen Gerinnungsstatus vortäuschen würde. Daher kann heute die Patienten-Temperatur am patientennah eingesetzten Gerät (Point of Care, POC) für das TEG eingestellt werden.
- Die gleiche Aussage gilt für den Säure-Basen-Status des Patienten, definiert durch seinen pH-Wert in Verbindung mit dem BE (Base Excess bzw. Basendefizit, mmol/l) sowie dem Kohlendioxid-Partialdruck (pCO2, mmHg) des Blutes. Wird die Gerinnungsdiagnostik heute so vorgenommen, dass Änderungen des pH- oder BE-Wertes unter der Diagnostik rückgängig gemacht werden, z. B. werden gepufferte Reagenzien eingesetzt, oder dass Änderungen des pH-Wertes zugelassen werden, z. B. steigt der pH der Probe im Sinne einer Alkalose infolge CO2-Verlust, dann kann eine Azidose-bedingte Gerinnungsstörung nicht mehr erfasst werden. Somit ist insbesondere die POC-Diagnostik zu verbessern. Dies gilt für die Präanalytik ebenso wie für die eigentliche Diagnostik. Alle möglichen Veränderungen von pH, BE und pCO2 gilt es zu verhindern, soll die aktuelle Gerinnungsdiagnostik des Patienten richtig durchgeführt werden.
Warum ist ein neues Therapieschema bei größerer Blutung erforderlich?
Offensichtlich führt die Strategie, die Massiv-Blutung mit Massiv-Transfusion zu therapieren, in eine Sackgasse: Die bestehende metabolische Azidose des Patienten verursacht kausal eine Coagulopathie, eine Massiv-Transfusion mit den üblichen 20 Tage alten EK‘s verstärkt diese Azidose und damit die Coagulopathie. Die für Trauma-Patienten typische metabolische Azidose sollte verhindert und nicht in Kauf genommen oder therapiert werden, weil sie, einmal entstanden, über Stunden ursächlich für das Blutungs-Risiko verantwortlich ist.
Eine Massiv-Transfusion schränkt die Wirksamkeit von rFVIIa (NovoSeven) ein, weil insbesondere alte EK‘s die Azidose unterhalten. Wenn überhaupt, dann wäre rFVIIa unbedingt vor der Gabe von EK‘s einzusetzen, und nicht, wie empfohlen (z. B. nach dem 8. EK), als „Ultima ratio“.
Da die Gerinnungsaktivität stark vom pH abhängt, kann der Verdacht geäußert werden, dass auch die Fibrinolyse und die sie modifizierenden Präparate, also auch z. B. Aprotinin oder Tranexamsäure, vom BD beeinflusst werden.
Wie könnte ein neues Therapieschema bei größerer Blutung aussehen?
Die Volumentherapie startet nicht mit einer kristalloiden sondern einer kolloidalen Lösung, und zwar - entscheidend - einer balancierten, d. h. den Elektrolyt- und Säure-Basen-Status nicht verändernden isotonen Lösung (z. B. HES 130/0,4 mit BEpot ~ 0 mmol/l), dabei wird die permissive Hämodilution bis zu einer cHb von ca. 7,5 g/dl in Kauf genommen.
Danach folgt die Gabe von tiefgefrorenem (FFP) oder lyophilisiertem Plasma (Lyo-Plasma) als Volumenersatz, Gabe von Gerinnungsfaktoren und prophylaktische Azidose-Therapie.
Erst wenn die cHb unter ca. 5-7 g/dl abfällt und Hypoxie-Zeichen auftreten (Tachykardie, EKG-Veränderungen, Anstieg von BD und Laktat), sind möglichst frische EK‘s indiziert.
Der Einsatz von rFVIIa kann nur sinnvoll sein, wenn zu keinem Zeitpunkt der Therapie eine nennenswerte metabolische Azidose vorgelegen hat. Dies gilt - unter Vorbehalt – auch für Fibrinolyse modifizierende Präparate und alle Arten von Gerinnungsfaktoren.

Verfügt der Patient über sein eigenes "Autoplasma" (lyophilisiertes Eigenplasma, pro Liter Plasma ein DIN-A4-Beutel in Briefformat mit einem Gewicht von ca. 75 g, gelagert bei Raumtemperatur), kann die Therapie extrem vereinfacht und optimiert werden, vermutlich kann auf die Gabe von EK‘s in vielen Fällen ganz verzichtet werden.
Dass die deutliche Reduktion der Gabe von EK‘s zu einer Senkung der Mortalität von Polytrauma-Patienten führt, wurde jetzt an über 5.000 Patienten (1993 - 2006) mit dem DGU-Traumaregister (Deutsche Gesellschaft für Unfallchirurgie) eindrucksvoll belegt.
Die zitierten Abbildungen und die Literatur findet sich unter Volumen- und Hämotherapie bei Massiv-Blutung
