
Das Basendefizit von TK´s ist dem pH-Wert als Qualitätskriterium überlegen
Gastkommentar von Dr. med. Jens Eckert (Zürich)
Einleitung
Thrombozyten-Konzentrate (TKs) spielen im medizinischen Alltag eine wichtige Rolle und werden häufig kritisch kranken Patienten transfundiert. Daher ist es von grosser Bedeutung, die Qualitätskriterien eines TK zu kennen, um den möglichen Vor- oder Nachteil für den Patienten zu beurteilen.
Qualitätskontrolle im Jahr 2011 bedeutet, durch das Paul Ehrlich-Institut (PEI) kontrolliert, eine optische Beurteilung der TKs, das so genannte „swirling“ sowie eine Einschätzung des Metabolismus und damit der Qualität durch den pH-Wert, welcher innerhalb 6,5 bis 7,4 liegen muss [12]. Als Alternative wurde hier die Entwicklung des Base Excess (BE) und der CD62-Zunahme unter der Lagerung untersucht. CD62 ist ein Oberflächenantigen, welches bei Stress exprimiert wird und in seiner Quantität eine Aussage über die Funktionstüchtigkeit nach Transfusion geben soll. Diese Werte wurden bezüglich ihrer Aussage über die TK-Qualität mit dem genannten pH-Wert verglichen.
Methodik
Über einen Zeitraum von mehreren Monaten wurde verfolgt, wie sich neben anderen nicht erwähnten Parametern der pH, Base Excess (BE) und CD62 in TKs im Verlauf vom Tag ihrer Abnahme (Tag 0) bis zum 7. Tag der Lagerung entwickeln.
Dabei wurde das gängige Verfahren der Apherese angewendet, die Thrombozyten waren leukozytendeplentiert und in Plasma mit ACDA-Zusatz gelagert. Das TK wurde in Haemonetics 1000 ml CPP Platelet Bags gewonnen, anschließend ein kleiner Teil des TKs in die am System befindlichen „Sampling bags“ abgefüllt, nach Verplombung abgetrennt und der weiteren Untersuchung zugeführt. Die Probenentnahme erfolgte unter strengen sterilen Bedingungen. Die TKs wurden bei 22 °C im Temperatur-Schrank auf einem TK-Schüttelgerät bis zur Transfusion gelagert. Für die Beobachtung standen ca. 300 Proben zur Verfügung, einige von ihnen wurden fortlaufend gemessen. Bei insgesamt 23 Proben wurden Folgemessungen durchgeführt: Bei 8 TKs wurde Tag 0, 5 und 7 gemessen, bei 12 TKs Tag 0, 6 und 7 und bei 2 TKs Tag 0 und 7. Auch solche TKs wurden eingeschlossen, die aufgrund ihrer Lagerzeit nicht mehr transfundiert werden durften: 32 TKs am Tag 5 und 7 und 14 TKs am Tag 6 und 7.
Die pH-Messung wurde mit 3 verschiedenen pH-Messgeräten durchgeführt, eine als Referenz dienende, anaerob messende Mikroelektrode (BMS Mk2 Blood Micro System, Radiometer Copenhagen), eine aerob messende und als typisches Standardmessgerät einer Transfusionszentrale verwendete Stabelektrode (Ino Lab pH Level 1 der Firma WTW) und ein anaerob messender Blutgasanalysator (BGA) auf Kassettenbasis (Opti CCA, Osmetech) zur Messung von pH und CO2-Partialdruck (pCO2, mmHg) sowie Berechnung des Base Excess (BE, mmol/l).
Die Bestimmung der CD62-aktivierten Thrombozyten erfolgte mit einem Flow Cytometer (FACScan und zugehöriger Autocomp Software). Hierzu wurden den zuvor vorbereiteten Proben 4 verschiedene Antikörper zugesetzt, welche die Exprimierung des Oberflächen-AG sichtbar machen.
Ergebnisse und Interpretation
pH und pCO2
Das in einer Transfusionszentrale üblicherweise verwendete pH-Meter, die Stabelektrode, zeigt gegenüber einer Mikroelektrode gemäß folgender Abbildung deutliche Abweichungen. Diese sind sowohl auf die unterschiedliche Temperatur der Systeme zurückzuführen, nämlich 22 (Stab) vs. 37 °C (Mikro), als auch auf die aerobe (Stab) vs. anaerobe (Mikro) Messung.
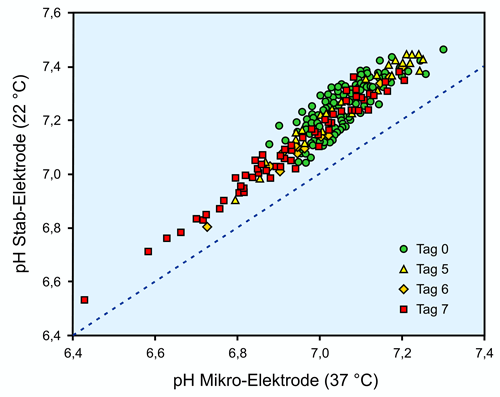
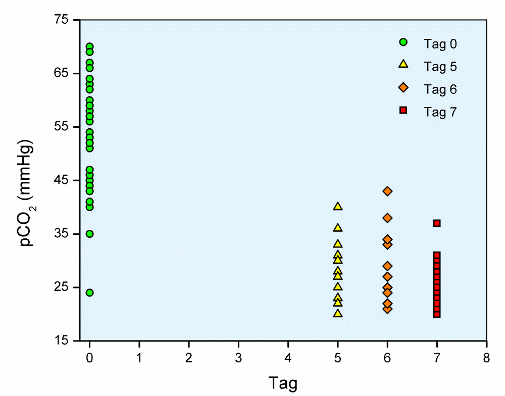
Zur Verdeutlichung der aeroben vs. anaeroben Messung sind in der folgenden Abbildung die zugehörigen CO2-Partiladrücke wiedergegeben. Es ist offensichtlich, dass die große Streuung des pCO2 am Tag 0 mit ca. 30 bis 70 mmHg einen erheblichen Einfluss auf den pH-Wert nehmen muss: 30 mmHg entspricht im normalen Plasma einem pH von 7,5 und ein Wert von 70 mmHg einem pH von 7,2. Allein dies entspricht schon fast der Variation des pH-Wertes am Tag 0. Die Abdiffusion von CO2 über das gasdurchlässige Beutelmaterial sorgt dann für einen kontinuierlichen Abfall des pCO2 auf ca. 20 - 30 mmHg und folglich deutlichen Anstieg des pH-Wertes.
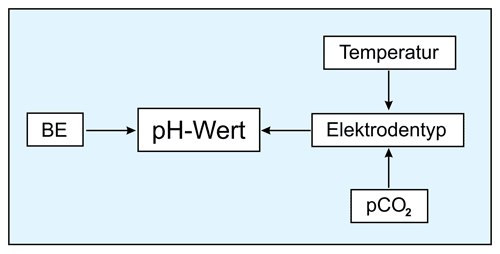
Damit wird offensichtlich, wie fragwürdig der pH-Wert als Qualitätskriterium für TKs einzuordnen ist (s. folgendes Schema): Die Temperatur (22 vs. 37 °C), der Elektrodentyp (anaerob vs. aerob) und der pCO2 (Lagerungs-Dauer und Bedingungen) bestimmen seinen Wert, mit dem eigentlich der metabolische Zustand des TKs beurteilt werden sollte, der allein vom BE der Probe abhängt.
Base Excess (BE) bzw. Basendefizit (BD)
Im Gegensatz zum pH-Wert lässt sich bei der Entwicklung des BE eine weitgehend kontinuierliche Abnahme aufzeigen, das Basendefizit (BD = negativer BE) steigt somit über die Lagerungszeit an. Dieser Befund dürfte vor allem darauf zurückzuführen sein, dass das BD per definitionem und nachweislich unabhängig vom pCO2 und von der Temperatur ist.
CD62-Aktivierung
Vergleichbar zum BD verhält sich die CD62-Exprimierung über die Lagerungszeit, es kommt zu einer kontinuierlichen Zunahme von Oberflächen-AG , der Verlauf korreliert erwartungsgemäß wegen der vielen Einflussgrößen aber nicht mit der Veränderung des pH-Wertes über die Lagerungszeit (s.u.).
Diskussion
pH-Wert
Werden die durch die Mikroelektrode gemessenen Proben verglichen mit denen der Stabelektrode, ergeben sich systematisch erhöhte pH-Werte. Diese lassen sich durch Abdiffusion von CO2 im Sinne einer Alkalisierung bei aerober Messung erklären und weisen damit auf eine Fehlerquelle hin, welche beim Messen mit der Stabelektrode unter alltäglichen Bedingungen nicht kontrollierbar ist. Die Wahl der Messtemperatur von 22 °C trägt zusätzlich zu der beschriebenen Differenz bei, allein praktische Gründe dürften dafür verantwortlich sein, dass vor Jahren nicht die üblichen 37 °C gewählt wurden.
Bereits 2005 wurde gezeigt [14], dass es in der heutigen Zeit keine Verbesserung der Qualitätskontrolle durch Zuhilfenahme des pH-Wertes gibt: Sowohl die modernen Apharese-Geräte zur Herstellung der TKs als auch die zugesetzten Komponenten zur Stabilisierung sollen in ihrer Variabilität nicht mehr mit ihren Vorgängern zu vergleichen sein, bei welchen der pH-Wert als der beste Wert zur Qualitätsbeurteilung galt. Bekannt ist lediglich, dass TKs, welche mit ihrem pH-Wert unter 6,0 - 6,2 liegen, starke bis irreversible Schäden aufweisen, welche zu starkem oder gar gänzlichem Funktionsverlust der Thrombozyten nach der Transfusion in den Empfängerorganismus führen [2, 5]. Ebenso scheint sich ein pH-Wert >7,2 negativ auf das so genannte „recovering“ (Erholung) und das „survival“ (Überleben) im Empfängerorganismus nach der Transfusion auszuwirken [7], daher sei die Qualitätskontrolle der TKs mittels pH-Messung überholt und wäre durch einen besseren Parameter zu ersetzen.
CD62
Der CD62-Wert hat sich in den letzten 15-20 Jahren als wichtiger Parameter zur Beurteilung der Funktionsfähigkeit des TK während Lagerung über mehrere Tage entwickelt. Der CD62-Wert, welcher eine Aktivierung von Oberflächen-Antigen darstellt [1], steigt über die Lagerungstage ständig. Bei der Transfusion der TKs werden unterschiedliche Beobachtungen gemacht: Bei gesunden Probanden entsteht eine gute inverse Korrelation von zuvor erfasster CD62-Aktivierung und anschließender beschleunigter Elimination aus dem Organismus [6]. Dies kann nicht ohne weiteres auf hämatologisch Erkrankte übertragen werden, was jedoch auch nicht primäres Ziel sein muss, wenn man eine in vitro-Kontrolle der TK-Qualität sucht. Insgesamt überwiegt die Ansicht, dass eine hohe Aktivität während der Lagerungstage zu einer schnelleren Elimination führt [2, 3, 4, 7, 10, 11, 13]. Es gilt daher, eine Aktivierung innerhalb der Lagerungszeit aufgrund einer abnehmenden Qualität bei Transfusionen zu verhindern [8, 15]. Ein Kritikpunkt für die tägliche Routinediagnostik in Bezug auf die CD62-Bestimmung sind jedoch die Kosten und die umständliche und zeitraubende sowie mit einer Vielzahl möglicher Fehler behaftete Untersuchung des CD-62 [9]. Daher ist es erstrebenswert, einen anderen Parameter zu identifizieren, welcher sich gleich dem CD62-Wert entwickelt und vergleichbar ist, ohne jedoch annähernd so aufwändig in der täglichen Bestimmung zu sein. Hierbei kommt der Korrelation zwischen der CD62-Entwicklung und der des BD über die Lagerungstage eine besondere Bedeutung zu, wie im folgenden Diagramm dargestellt
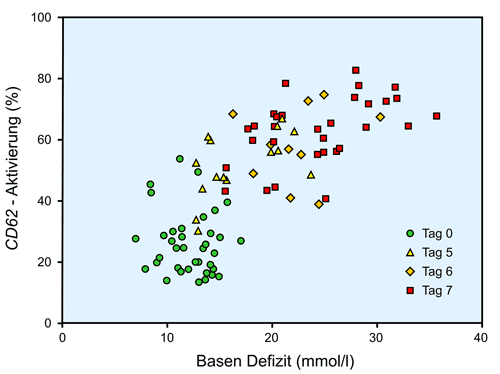
Es ist offensichtlich, dass eine gute Korrelation zwischen dem Basen Defizit und der CD62-Aktivierung besteht. Eine solche Korrelation besteht nicht zum pH-Wert (37 °C), wie die folgende Abbildung zeigt (methodisch bedingte größere Fallzahl).
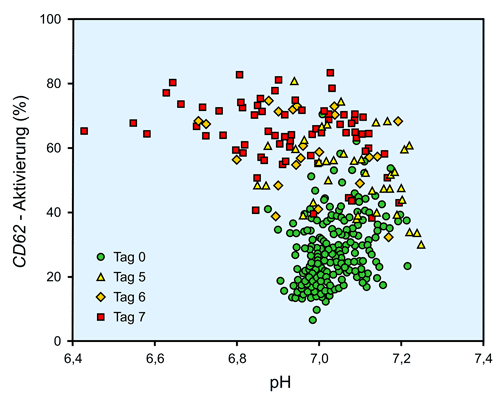
BD (= neg. BE)
Die Bedeutung des Basendefizits (BD) in Bezug auf den pH-Wert kann anhand des folgenden Beispiels aufgezeigt werden:
Ein TK mit einem pH von 7,05 (typischer Wert bei 37 °C am Tag 0) hat bei einem pCO2 von 65 mmHg ein BD von 10 mmol/l (frisches TK) und beim gleichen pH von 7,05 aber pCO2 von 28 mmHg ein BD von 20 mmol/l (altes TK). Das bedeutet, dass der pCO2 bzw. das Beutelmaterial jeden pH vortäuschen kann, das BD hingegen ist nicht durch pCO2 und seinen Einfluss auf den pH beeinflussbar (sinkt z.B. der pCO2, steigt der pH in einem definierten Maß ohne Einfluss auf das BD), ebenso kommt es zu keinem direkten Einfluss der Temperatur auf das BD. Das BD wird allein durch den Metabolismus im TK modifiziert. Dieser Zusammenhang wird mit dem folgenden Schema veranschaulicht.
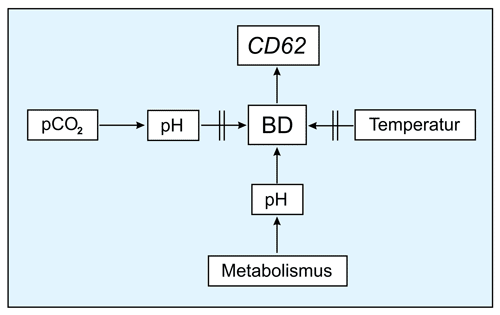
Sowohl die direkte Korrelation des BD und des CD62-Wertes sowie die Tatsache, dass das BD die tatsächlichen metabolischen Veränderungen, welche auf die Qualität des TK einen maßgeblichen Einfluss haben, anzeigt und, nicht wie der pH-Wert, durch Temperatur und Abdiffusion von CO2 modifiziert werden kann, bekräftigt die Forderung, dass das BD als zukünftige Größe in der Evaluation der TK-Qualität etabliert werden sollte. Diese Forderung, also Qualitätskontrolle über den Base Excess (bzw. das Basen-Defizit), wurde schon vor Jahren für Erythrozyten-Konzentrate beschrieben [16].
Fazit
Das Basen-Defizit (neg. BE), mit einem Blutgasanalysator bei 37 °C aus pH und pCO2 ermittelt, ist dem pH-Wert als Qualitätskriterium für Thrombozyten-Konzentrate überlegen: Unabhängig von den Lagerungsbedingungen (Temperatur, pCO2) wird es nur vom Metabolismus der Thrombozyten bestimmt und korreliert mit der CD62-Aktivität.
Literatur
- Badlou BA, Ijseldijk MJW, Smid WM, Akkerman, JWN:
Prolonged platelet preservation by transient metabolic suppression.
Transfusion 2005; 45: 214 - 222 - Cardigan R, Turner C, Harrison P:
Current methods of assessing platelet function: relevance to transfusion medicine.
Vox Sanguinis 2005; 88: 153 - 163 - deWildt Eggen J, Schrijver JG, Bins M, Gullikson H:
Storage of platelets in additive solutions: effects of magnesium and/or potassium.
Transfusion 2002; 42: 76 - 80 - deWildt Eggen J, Gullikson H:
In vivo and in vitro comparison of platelets stored in either synthetic media or plasma.
Vox Sanguinis 2003; 84: 256 - 264 - Dumont LJ, AuBuchon JP, Whitely P, Herschel LH et al.:
Seven day storage of single donor platelets: recovery and survival in an autologous transfusion study.
Transfusion 2002; 42: 847 - 854 - Dumont LJ, Beddard R, Whitely P, Johnson A et al.:
Autologous transfusion recovery of WBC-reduced high-concentration platelet concentrates.
Transfusion 2002; 42: 1333 – 1339 - Dumont LJ, Van den Broeke T:
Seven day storage of apheresis platelets: report of an in vitro study.
Transfusion 2003; 43: 143 - 150 - Gutensohn K, Geidel K, Brockmann M, Siemensen M et al.:
Binding of activated platelets to WBCs in vivo after transfusion.
Transfusion 2002, 42: 1373 - 1380 - Linn YA, Hyun BH:
Evaluation of platelet parameters on the ADVIA 120 as the quality indicator for stored platelets.
Clin Haem Lab 2002; 24: 377 – 384 - Karnicki K, Johnson C, St Cyr J, Ericson D, Rao G:
Platelet storage solution improves the in vitro function of preserved platelet concentrate.
Vox Sanguinis 2003, 85: 262 – 266 - Kutlay S, Osman I, Onder A, Beksac M:
Influence of storage time on activation of platelets collected with CS 3000 and Cobe spectra using platelet storage containers.
Ther Apher 2002, 6: 82 - 85 - Richtlinien der Bundesärztekammer zur Gewinnung von Blut und Blutbestandteilen und zur Anwendung von Blutprodukten (Hämotherapie) (gemäß §§ 12 und 18 TFG)
- Stohlawetz P, Horvath M, Pernerstorfer T, Nguyen H et al.:
Effects of nitric oxide on platelet activation during plateletpheresis and in vivo tracking of biotinylated platelets in humans.
Transfusion 1999; 39: 506 - 510 - Tudisco C, Jett BW, Byrne K, Oblitas J et al.:
The value of pH as a quality control indicator for apheresis platelets.
Transfusion 2005; 45:773 - 778 - Wagner T, Vetter A, Dimovic N, Guber SE et al.:
Ultrastructural changes and activation differences in platelet concentrates stored in plasma and additive solution.
Transfusion 2002, 42: 719 - 727 - Zander R, Sümpelmann R:
Säure-Basen-Status gelagerter und gewaschener Erythrozyten.
Anästhesiol Intensivmed Notfallmed Schmerzther 2001: 36 (Suppl. 1): 25 - 30
Anmerkung
Die Ergebnisse entstammen der medizinischen Dissertation von Herrn Dr. med. Jens Eckert (Zürich). Die Untersuchungen wurden in der Transfusionszentrale der Universitätsmedizin Mainz durchgeführt.
