
Volumen- und Hämotherapie bei Massiv-Blutung
Hintergrund
Unter dem Titel „Base Excess und Gerinnung“ wurden hier am 26.09.06 Fakten veröffentlicht, die einen kausalen, klinisch relevanten Zusammenhang zwischen dem Base Excess (BE, mmol/l) und der Gerinnung des Blutes, dargestellt am Beispiel Quickwert (%), belegen.
Verkürztes Fazit
- Eine metabolische Azidose kann ursächlich das Blutungs-Risiko von Trauma-Patienten erhöhen.
- Die Gerinnungsdiagnostik muss unbedingt unter den aktuellen Bedingungen des Patienten durchgeführt werden.
- Der Einsatz von rFVIIa (NovoSeven) erfordert eine Korrektur der Körpertemperatur auf mindestens 35 °C und der Azidose auf BE ? - 12,5 mmol/l.
Therapie bei Massiv-Blutung
Zum Thema „Trauma und Blutung“ (Wilhelmsbader Symposium 30.06.07) wurden neue Daten vorgestellt, die in konkrete Vorschläge zur Therapie großer Blutverluste münden. Diese Daten werden hier wiedergegeben, wobei auch solche aus „Base Excess und Gerinnung“ wiederholt werden.
Folgende Punkte werden behandelt:
- Base Excess und Mortalität
- Base Excess und Gerinnung
- Base Excess von Blutprodukten
- Coagulopathie bei Massivtransfusion
- Mittleres Alter transfundierter EK´s
- Anzahl und Alter transfundierter EK´s und Mortalität
- Base Excess und Überleben bei Massivtransfusion
- Volumen- und Hämo-Therapie bei großen Blutverlusten
Base Excess und Mortalität
Zusammenhang von Base Excess bei Krankenhaus-Aufnahme und späterer Mortalität von Polytrauma-Patienten:
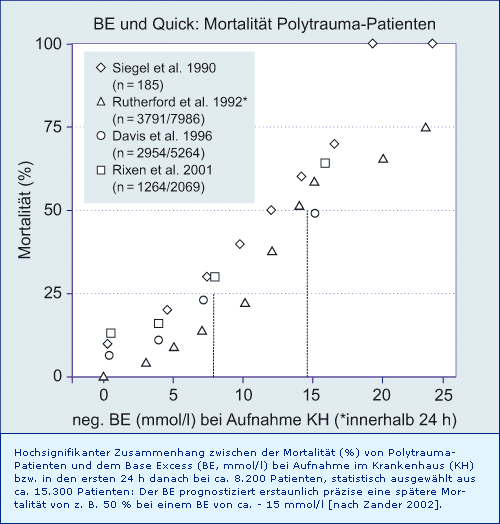
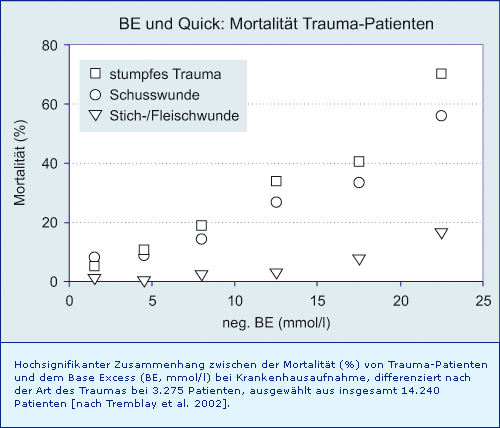
Zusammenhang zwischen dem Base Excess bei Krankenhaus-Aufnahme und der späteren Mortalität von Trauma-Patienten, differenziert nach der Art des Traumas:
Fazit
Ein BE von ca. - 15 mmol/l bei Krankenhaus-Aufnahme prognostiziert bei Polytrauma-Patienten eine spätere Mortalität von ca. 50 %. Ähnliches gilt für Trauma-Patienten mit stumpfem Trauma oder Schusswunde (Mortalität ca. 50 % bei BE ca. - 20 mmol/l), bei Stich- oder Fleischwunden zeigen sich deutlich bessere Überlebenschancen.
Base Excess und Gerinnung
Zusammenhang zwischen dem BE- und dem Quick-Wert schwer verletzter Polytrauma-Patienten:
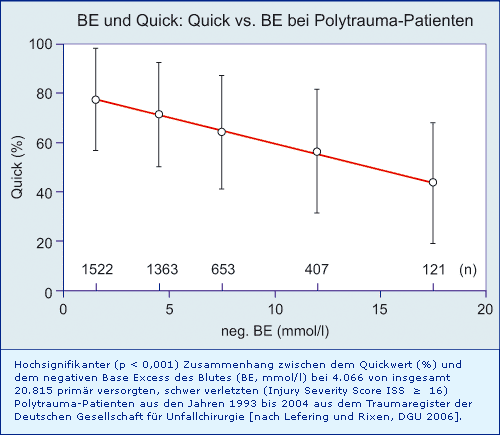
Fazit
Neben dem Alter, ISS (Injury Severity Score), GCS (Glasgow Coma Score) und Verletzungsmuster (Kopf und Extremitäten) sind die beiden wichtigsten, vom Arzt beeinflussbaren prädiktiven Faktoren der späteren Mortalität, der BE- und der Quick-Wert. Für diese beiden Größen besteht bei über 4.000 Polytrauma-Patienten ein hochsignifikanter Zusammenhang, bei einem BE von ca. - 15 mmol/l beträgt der Quick-Wert nur noch ca. 50 %.
Base Excess von Blutprodukten
Die Herstellung und Lagerung von Blutprodukten führt dazu, dass diese einen negativen BE aufweisen, der beim Patienten eine metabolische Azidose erzeugt.
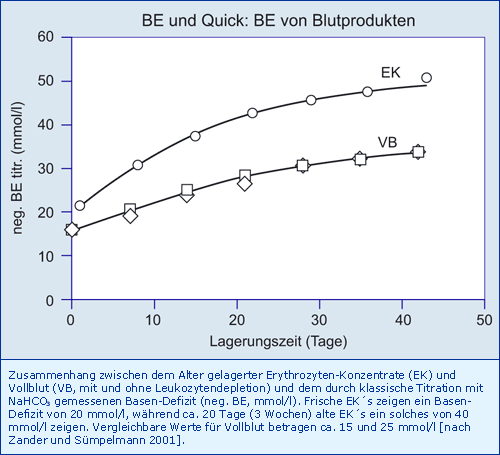
Fazit
Eine Massiv-Transfusion verursacht eine metabolische Azidose, weil frische Erythrozyten-Konzentrate einen BE von - 20 und 20 Tage alte EK`s einen BE von - 40 mmol/l haben. Nicht dargestellt: Plasma (FFP) wirkt stark alkalisierend (hohe Citrat-Konzentration).
Coagulopathie bei Massiv-Transfusion
Trauma-Patienten mit Massiv-Transfusion entwickeln je nach Basen-Defizit (negativer BE) eine Coagulopathie. Dies führt dazu, dass in internationalen Empfehlungen zum Einsatz von rekombinantem Gerinnungs-Faktor VIIa (rFVIIa, NovoSeven) eine metabolische Azidose als Ausschlusskriterium gilt.
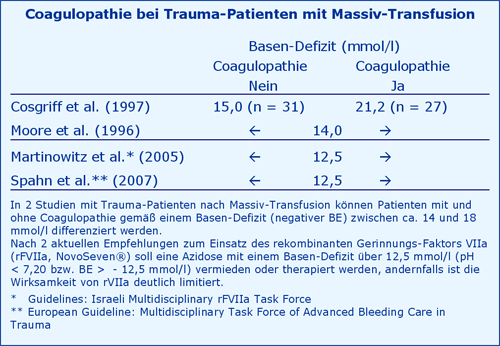
Fazit
Eine Massiv-Transfusion erzeugt eine metabolische Azidose mit einem Basen-Defizit von 14 bis 20 mmol/l, das geeignet ist, Patienten mit und ohne Coagulopathie zu differenzieren. Ein Einsatz von rFVIIa (NovoSeven) ist dann Azidose-bedingt limitiert.
Namens der Israeli Multidisziplinary rFVIIa Task Force empfehlen Martinowitz et al. in 2005: “Correction of the pH to ? 7.2 is recommended prior to its administration”. Ein pH von 7,2 entspricht einem BE von - 12,5 mmol/l einer nicht-respiratorischen Azidose.
Spahn et al. (2007) gehen noch weiter: Eine Korrektur des pH vor dem Einsatz von rFVIIa (NovoSeven) „should be restored as near to the physiological level as possible“, wofür es vorläufig keine Daten gibt.
Namens der NovoSeven Trauma Study Group veröffentlichen Boffard et al. (2005) die Ergebnisse einer Multicenter-Studie: Coagulopathie, metabolische Azidose und Hypothermie sind die „letale Trias“, die es zu durchbrechen gilt. Ausschluss-Kriterium hier u. a. ein Base Excess > - 15 mmol/l. Nach der 8. EK-Transfusion wurden 143 Patienten mit strumpfem und 134 mit penetrierendem Trauma mit rVIIa (NovoSeven) therapiert. Beim stumpfen Trauma reduzierte sich die Anzahl der erforderlichen EK’s um 2,6 EK’s (1,0 EK beim penetrierenden Trauma) und das Erfordernis zur Massivtransfusion (> 20 Einheiten) innerhalb von 48 h von 33 auf 14 % (von 19 auf 7 % beim penetrierenden Trauma).
Beurteilung durch Byhahn (2006): Eine zwar statistisch signifikante, klinisch betrachtet jedoch eher marginale Reduktion des Bedarfs an EK-Transfusionseinheiten bei schwer verletzten Patienten.
Fazit
Coagulopathie, metabolische Azidose und Hypothermie werden als „letale Trias“ bezeichnet, was so nicht zutrifft, weil die Azidose die Coagulopathie kausal bedingt. Somit reduziert sich diese Trias auf Azidose und Hypothermie allein.
Eine Massiv-Transfusion, insbesondere mit alten EK’s, kann die Wirksamkeit von rVIIa (NovoSeven) beeinträchtigen, weil die EK’s die Azidose unterhalten oder verstärken. Wenn überhaupt, dann wäre rVIIa unbedingt vor der Gabe von EK´s einzusetzen, und nicht, wie so häufig (z. B. nach dem 8. EK, s. o.), als „Ultima ratio“.
Mittleres Alter transfundierter EK´s
Das mittlere Alter von Erythrozyten-Konzentraten (EK´s) beträgt zum Zeitpunkt der Transfusion relativ einheitlich ca. 20 Tage.
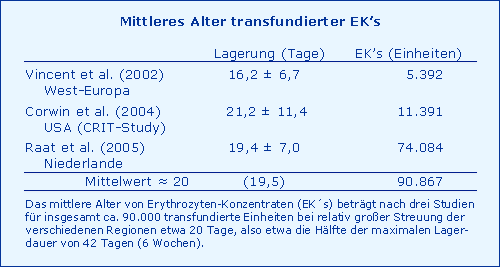
Fazit
Wenn das mittlere Alter transfundierter EK´s 20 Tage beträgt, dann wird dem Patienten bei einer Massivtransfusion pro 3 EK´s (ca. 1 l) ein Betrag von 40 mmol H+-Ionen zugeführt, etwa der Betrag, den die Niere normalerweise pro Tag zu eliminieren hat (50 mmol). Vergleichbar eines akuten Nierenversagens erzeugt dies beim Patienten (75 kg KG) ein Basen-Defizit (neg. BE) von ca. 3 mmol/l im Blut bzw. im gesamten Extrazellularraum, also eine metabolische Azidose mit der Gefahr der Coagulopathie.
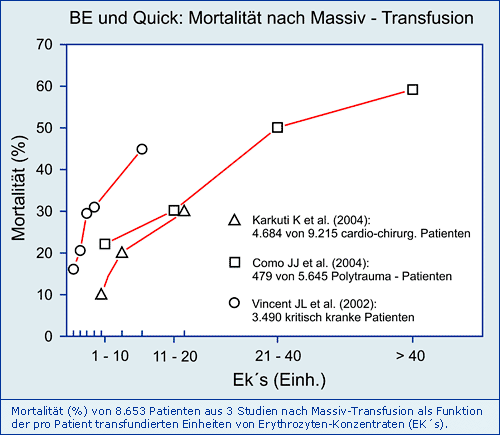
Anzahl und Alter transfundierter EK´s und Mortalität
Allein die Anzahl transfundierter EK’s hat einen Einfluss auf die Mortalität:
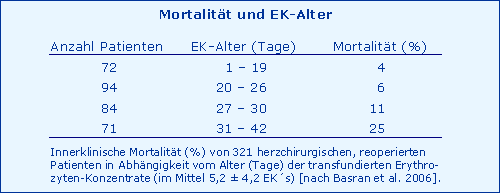
Auch das Alter transfundierter EK’s hat einen Einfluss auf die Mortalität:
Fazit
Allein die Anzahl transfundierter EK’s (3 Studien) aber auch das Alter transfundierter EK’s (1 Studie) hat einen möglichen Einfluss auf die Mortalität. Die Vermutung liegt nahe, dass das Basen-Defizit (neg. BE) der EK´s dafür verantwortlich ist, weil der BE mit der Lagerung der EK´s abnimmt und damit die metabolische Azidose noch verstärkt wird, die ihrerseits die Coagulopathie verursacht.
Base Excess und Überleben bei Massiv-Transfusion
In mehreren Studien konnte gezeigt werden, dass bei Trauma-Patienten mit Massiv-Transfusion Überlebende und Verstorbene gemäß ihrem Basen-Defizit (negativer BE) differenziert werden können:

Je nach Anzahl der transfundierten EK´s unter Massiv-Transfusion entwickeln Trauma-Patienten eine metabolische Azidose, die ab einem BE von etwa - 20 mmol/l ein Überleben verhindert:
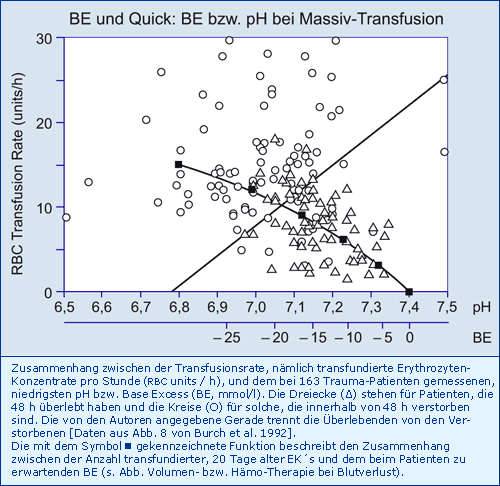
Fazit
Das Überleben nach Massiv-Transfusion wird vom BE der metabolischen Azidose bestimmt, weil der negative BE seinerseits die Coagulopathie verursacht.
Volumen- und Hämo-Therapie bei großen Blutverlusten
Offensichtlich führt die Strategie, eine Massiv-Blutung mit einer Massiv-Transfusion zu therapieren, in eine Sackgasse: Die bestehende metabolische Azidose des Patienten verursacht kausal eine Coagulopathie, eine Massiv-Transfusion mit den üblichen 20 Tage alten EK`s verstärkt die Azidose und damit die Coagulopathie.
Mit der folgenden Abbildung werden drei mögliche Strategien zur Behandlung eines großen Blutverlustes vorgestellt: Volumentherapie mit permissiver Hämodilution mit einer kristalloiden Lösung (0,9 % NaCl) oder mit einer balancierten kolloidalen Lösung sowie die isovolämische Transfusion frischer oder 20 Tage alter EK´s zur Gewährleistung einer weitgehend normalen Hb-Konzentration (cHb).
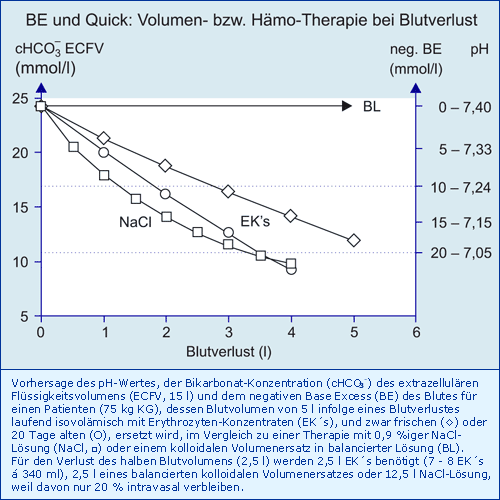
Fazit
Am Beispiel des Verlustes des halben Blutvolumens eines Patienten können folgende Therapie-Vorschläge abgeleitet werden:
Mit ca. 8 EK´s kann der Verlust isovolämisch ausgeglichen werden, die cHb bleibt normal, mit frischen EK´s wird ein Basen Defizit von 10 mmol/l mit beginnender Coagulopathie erzeugt, mit den üblichen 20 Tage alten EK´s aber ein Basen-Defizit von 15 mmol/l mit ausgeprägter Coagulopathie, die die Blutungsneigung deutlich verstärkt.
Die Therapie mit einer kristalloiden Lösung erfordert nicht nur sehr große Volumina, nämlich 12,5 l (nur 20 % verbleiben intravasal), sondern erzeugt eine Dilutions-Azidose mit einem Basen-Defizit von ca. 17,5 mmol/l mit der Folge einer ausgeprägten Coagulopathie, die die Blutung wieder erheblich verstärkt.
Eine Therapie mit einer balancierten, d. h. den Säure-Basen-Status nicht verändernden kolloidalen Lösung (z. B. HES 130/0,4 mit BEpot 0 mmol/l), nimmt die permissive Hämodilution mit einer cHb von 7,5 g/dl in Kauf.
Das von Spahn und Rossaint (2005) vertretene Schema zur Flüssigkeits- bzw. Blutkomponenten-Therapie bei größerer Blutung, übernommen von Hardy et al. (2006) bzw. Erber et al. (2002), ist somit dringend revisionsbedürftig bezüglich der Reihenfolge der applizierten Therapeutika: Nicht zuerst Kristalloide, dann Kolloide, dann EK´s und dann FFP, sondern zuerst balancierte Kolloide, dann FFP (Volumenersatz, Gerinnungsfaktoren, Azidose-Prävention) und erst dann (möglichst frische) EK´s, wenn die cHb mehr oder weniger deutlich unter 5 – 7 g/dl abgefallen ist.
Generelles Fazit
- Die für Trauma-Patienten typische metabolische Azidose sollte verhindert, nicht in Kauf genommen oder therapiert werden, weil sie ursächlich für das Blutungs-Risiko verantwortlich ist: Beim BE von - 15 mmol/l ist die Gerinnungsaktivität in vitro und in vivo auf ca. 50 % gesenkt, die Mortalität von Polytrauma-Patienten beträgt dann ca. 50 %. Eine engmaschige Kontrolle des Base Excess ist daher unbedingt zu empfehlen.
- Die Aufrechterhaltung der Normovolämie steht im Vordergrund, dazu müssen primär balancierte, kolloidale Infusionslösungen verwendet werden. Eine Transfusion möglichst frischer EK’s sollte erst am Limit der permissiven Hämodilution erfolgen, da die Transfusion die metabolische Azidose und damit die Blutungsneigung unterhält.
- Die Gerinnungsdiagnostik muss unbedingt unter den aktuellen Bedingungen des Patienten durchgeführt werden, also Körpertemperatur (z. B. Hypothermie 30 °C) und Säure-Basen-Status (z. B. Azidose mit BE - 15 mmol/l), eine Diagnostik bei 37 °C und BE = 0 mmol/l würde einen normalen Gerinnungs-Status vortäuschen.
- Der Einsatz von rFVIIa (NovoSeven) kann nur sinnvoll sein, wenn keine nennenswerte metabolische Azidose vorliegt (Basen-Defizit < 12,5 mmol/l); eine Therapie mit rFVIIa im Verlauf einer Massivtransfusion mit (alten) EK’s ist unbedingt zu vermeiden. Ob eine Therapie der Azidose den Einsatz von rFVIIa verbessert, bleibt abzuwarten.
Offene Fragen
- Ob die Therapie einer metabolischen Azidose, also weitgehende Normalisierung des BE durch Gabe von Bikarbonat oder Tris, zu einer Wiederherstellung der zuvor gestörten Gerinnung führt, kann vorläufig nicht beantwortet werden, da die entsprechenden Tierversuche ein sehr uneinheitliches Bild liefern.
- Inwieweit der Einsatz von frischem Vollblut von Vorteil ist, bleibt abzuwarten, entsprechende Fallberichte sprechen dafür.
- Welche Maßnahmen nötig sind, die patientennahe (POC) Diagnostik so zu verbessern, dass die aktuellen Patienten-Daten des Säure-Basen-Status und der Körpertemperatur erhalten bleiben, muss geklärt werden.
- Die Definition der Massiv-Blutung bzw. -Transfusion wird sehr uneinheitlich verwendet, z. B. als relativer Austausch des Blutvolumens (1 BV in 24 h oder ½ BV in 3 h, Spahn et al. 2007) oder als EK-Gabe pro Tag (von > 10 bis > 50 EK´s in 24 h (Cosgriff et al. 1997; Cinat et al. 1999).
Literatur
Basran S, Frumento RJ, Cohen A, Lee S, Du Y, Nishanian E, Kaplan HS, Stafford-Smith M, Bennett-Guerrero E
The association between duration of storage of transfused red blood cells and morbitity and mortality after reoperative cardiac surgery
Anesth Analg 2006; 103: 15 - 20
Boffard KD, Riou B, Warren B, Choong PIT, Rizoli S, Rossaint R, Exelsen M, Kluger Y for the NovoSeven Trauma Study Group
Recombinant factor VIIa as adjunctive therapy for bleeding control in severly injured trauma patients: Two parallel randomized, placebo-controlled, double-blind clinical trials
J Trauma 2005; 59: 8 - 18
Burch JM, Ortiz VB, Richardson RJ, Martin RR, Mattox KL, Jordan GL
Abbreviated laparotomy and planned reoperation for critically injured patients
Ann Surg 1992; 215: 476 - 484
Byhahn C
Reduziert rekombinanter, aktivierter Faktor VII den Fremdblutbedarf bei polytramatisierten Patienten?
Anaesthesist 2006; 55: 578 - 580
Cinat ME, Wallace WC, Nastanski F, West J, Sloan S, Ocariz J, Wilson SE
Improved survival following massive transfusion in patients who have undergone trauma
Arch Surg 1999; 134: 964 - 970
Como JJ, Dutton RP, Scalea TM, Edelman BB, Hess JR
Blood transfusion rates in the care of acute trauma
Transfusion 2004; 44: 809 - 813
Corwin HL, Gettinger A, Pearl RG, Fink MP, Levy MM, Abraham E, MacIntyre NR, Shabot MM, Duh MS, Shapiro MJ
The CRIT study: Anemia and blood transfusion in the critically ill - current clinical practice in the United States
Crit Care Med 2004; 32: 39 - 52
Cosgriff N, Moore EE, Sauaia A, Kenny-Moynihan M, Burch JM, Galloway B
Predicting life-threatening coagulopathy in the massively transfused trauma patient: Hypothermia and acidosis revisited
J Trauma 1997; 42: 857 - 862
Erber WN
Massive blood transfusion in the elective surgical setting
Transfus Apheresis Sci 2002; 27: 83 - 92
Ferrara A, MacArthur JD, Wright HK, Modlin IM, McMillan MA
Hypothermia and acidosis worsen coagulopathy in the patient requiring massive transfusion
Am J Surg 1990; 160: 515 - 518
Garrison JR, Richardson JD, Hilakos AS, Spain DA, Wilson MA, Miller FB, Fulton RL
Predicting the need to pack early for severe intra-abdominal hemorrhage
J Trauma 1996; 40: 923 - 929
Hardy JF, Moerloose P de, Samama M
Massive transfusion and coagulopathy pathophysiology and implications for clinical management
Can J Anesth 2004; 51: 293 - 310
Karkouti K, Wijeysundera DN, Yau TM, Beatti WS, Abdelnaem E, McCluskey SA, Ghannam M, Yeo E, Djaiani G, Karski J
The independent association of massive blood loss with mortality in cardiac surgery
Transfusion 2004; 44: 1453 - 1462
Lefering R, Rixen D
Auszug aus dem Traumaregister der DGU (Deutsche Gesellschaft für Unfallchirurgie)
Institut für Forschung in der Operativen Medizin, Fakultät für Medizin, Private Universität Witten/Herdecke, Köln 2006
Martinowitz U, Michaelson M on behalf of the Multidisciplinary rFVIIa Task Force
Guidelines for the use of recombinant activated factor VII (rFVIIa) in uncontrolled bleeding: a report by the Isreali Multidisciplinary rFVIIa Task Force
J Thromb Haemost 2005; 3: 640 - 648
Moore EE
Staged laparotomy for the hypothermia, acidosis, and coagulopathy syndrome
Am J Surg 1996; 172: 405 - 410
Raat NJ, Berends F, Verhoeven AJ, de Korte D, Ince C
The age of stored red blood cell concentrates at the time of transfusion
Transfus Med 2005; 15: 419 - 423
Spahn DR, Rossaint R
Coagulopathy and blood component transfusion in trauma
Br J Anaesth 2005; 95: 130 - 139
Spahn DR, Cerny V, Coats TJ, Duranteau J, Fernandez-Mondejar E, Gordini G, Stahel PF, Hunt BJ, Komadina R, Neugebauer E, Ozier Y, Riddez L, Schultz A, Vincent JL, Roissant R
Management of bleeding following major trauma: a European guideline
Crit Care 2007; 11: 1 - 22
Tremblay LN, Feliciano DV, Rozycki GS
Assessment of initial base deficit as a predictor of outcome: mechanism of injury does make a difference
Am Surg 2002; 68: 689 - 693
Vincent JL, Baron JF, Reinhart K, Gattinoni L, Thijs L, Webb A, Meier-Hellmann A, Nollet G, Peres-Bota D for the ABC Investigators
Anemia and blood transfusion in critically ill patients
JAMA 2002; 288: 1499 - 1507
Zander R
Base Excess und Laktatkonzentration von Infusionslösungen und Blutprodukten
Anästhesiol Intensivmed Notfallmed Schmerzther 2002; 37: 359 - 363
© Georg Thieme Verlag · Stuttgart
Zander R, Adams HA, Boldt J, Hiesmayr MJ, Meier-Hellmann A, Spahn DR, Standl T
Forderungen und Erwartungen an einen optimalen Volumenersatz
Anästhesiol Intensivmed Notfallmed Schmerzther 2005; 40: 701 - 719
© Georg Thieme Verlag · Stuttgart
Zander R, Sümpelmann R
Säure-Basen-Status gelagerter und gewaschener Erythrozyten
Anästhesiol Intensivmed Notfallmed Schmerzther 2001: 36 (Suppl. 1): 25 - 30
Danksagung
Dr. Rolf Lefering (IFOM - Institut für Forschung in der Operativen Medizin Köln) und Priv.-Doz. Dr. med. Dieter Rixen (Chirurgische Klinik am Klinikum Köln-Merheim) haben freundlicherweise den Auszug aus dem Traumaregister der Deutschen Gesellschaft für Unfallchirurgie zur Verfügung gestellt
