
Isotonie
Die Gemeinsamkeit von Muttermilch, Kokosmilch, alkoholfreiem Bier, Sportgetränken und optimalen Infusionslösungen – Isotonie
Definition der Isotonie (isoosmotisch = isoton)
Das osmotische Gleichgewicht zwischen den verschiedenen Kompartimenten des Organismus ist dann gegeben, wenn die Anzahl der osmotisch wirksamen Teilchen (Osmole) im zur Verfügung stehenden Wasserraum ausgeglichen ist. Beispielsweise steht die frei permeable Glukose dann zwischen Erythrozyt (Wassergehalt 71 %) und Plasma (Wassergehalt 94 %) im Gleichgewicht, wenn die Konzentrationen im zur Verfügung stehenden Wasserraum (l ≈ g H2O) gleich sind. Daher ist der Bezug auf ein Kilogramm Wasser, also Osmolalität (mosmol/kg H2O) physiologisch zwingend, der Bezug auf ein Liter Erythrozyt oder Plasma (mosmol/l) würde sehr unterschiedliche Konzentrationen vortäuschen. Tatsächlich wurde durch Messung experimentell belegt, dass die Osmolalität aller Körperflüssigkeiten einschließlich Erythrozyten in keinem Falle eine Abweichung von mehr als 1 mosmol/kg H2O vom Plasmawert aufweist.
Hat eine Lösung den gleichen osmotischen Druck wie das Zellinnere, ist sie isoosmotisch und erzeugt an der nur für Wasser durchlässigen (näherungsweise semipermeablen) Zellmembran keine Wasser-Diffusion – weder hinein noch hinaus – und damit keine hydrostatische Druckdifferenz.
Da der osmotische Druck nicht als hydrostatische Druckänderung gemessen werden kann, wird zur Charakterisierung des osmotischen Druckes die Osmolalität (mosmol/kg H2O) verwendet, üblicherweise über die Gefrierpunkts-Depression (GPD) gemessen, die der Osmolalität direkt proportional ist.
Mit der Bezeichnung Tonizität hingegen wird das funktionelle Verhalten beschrieben, d. h., ob eine Zelle in einer Lösung durch Wasseraufnahme anschwillt oder durch Wasserabgabe schrumpft. Eine Lösung ist isoton, wenn in sie eingebrachte Zellen weder schrumpfen noch schwellen. Isoosmotisch und isoton werden synonym verwendet, d. h., eine isotone Lösung ist mit 288 mosmol/kg H2O isoosmotisch wie das Blutplasma sowie alle Körperzellen.
Will man die Osmolalität mit der Tonizität vergleichen, kann man die Erythrozyten in vitro als biologische Osmometer einsetzen. Die sogenannte physiologische 0,9 %ige NaCl-Lösung ist mit 286 mosmol/kg H2O (308 mosmol/l) gemessen am Plasmawert von 288 mosmol/kg H2O minimal hypoton. Bringt man Erytrozyten in diese Lösung mit ihrer minimalen Osmolalitätsdifferenz ein, kann man diese an der Abnahme der MCHC (mittlere korpuskuläre Hb-Konzentration) gerade noch ablesen, weil das MCV (mittleres korpuskuläres Volumen) in Relation zur cHb zunimmt (cHb/Hct). Dazu muss sowohl die cHb sehr genau bestimmt werden (gravimetrische Hb-Bestimmung) als auch der Hct (Mikro-Hämatokrit-Zentrifuge, mehrfach zentrifugieren, Ablesen mit Lupe). Der Quotient cHb/Hct ergibt die Abnahme des MCHC und wird hier als Zunahme des MCV angegeben. Das Ergebnis ergibt einen Wert von 101 ± 0,9 % (n = 25). Offensichtlich reagieren die Erythrozyten auf eine minimale äußere Osmolalitäts-Senkung mit einer minimalen, gerade noch messbaren Volumenzunahme. Damit ist belegt, dass die Angabe der Osmolalität in mosmol/kg H2O geeignet ist, die Tonizität zu beschreiben. Und es ist auch belegt, dass der Normalwert der Osmolatität mit 288 mosmol/kg H2O richtig ist.
Das Verhalten der GPD-Messung im Labor "in vitro" kann sich von der Wirkung am Patienten "in vivo" unterscheiden. Als Beispiel dafür gilt die 5 %ige Glukose-Lösung, die in vitro isoton ist (290 mosmol/kg H2O), in vivo aber wie Aqua dest. extrem hypoton wirkt, weil die Glukose im Organismus schnell metabolisiert wird. Als weiteres Beispiel kann eine 1,74 %ige Harnstoff-Lösung genannt werden, die in vitro über die GPE mit 290 mosmol/kg H2O als isoton einzustufen ist, in vivo aber wie eine hypotone Lösung wirkt, weil Harnstoff frei permeabel (MW 60) schnell in das Zellinnere unter Mitnahme von Wasser eintritt.
Zufällig ist – nur im Falle von Plasma – die Osmolarität (mosmol/l) praktisch identisch mit der Osmolalität (mosmol/kg H2O), egal ob gemessen oder berechnet, wie die folgende Tabelle zeigt.

Wenn die Osmolarität (mosmol/l) von Plasma zufällig mit der Osmolalität (mosmol/kg H2O) übereinstimmt, dann liegt dies daran, dass der Wassergehalt (0,94) den osmotischen Koeffizienten von NaCl (0,926) praktisch gerade ausgleicht. Dies gilt aber nicht für Infusionslösungen mit einem Wassergehalt von fast 100 %.
Die richtige Berechnung der Osmolalität, ebenfalls in der Tabelle dargestellt, ergibt das gleiche Ergebnis wie die Messung.
Muttermilch
Auch die Muttermilch (Zahlenwerte für Kuhmilch in Klammern) ist eine nahezu isotone Flüssigkeit, ihre Osmolalität beträgt 300 (288) mosmol/kg H2O. Die Trockenmasse von 129 (124) g/l, vornehmlich bestehend aus Fett mit 45 (38) g/l, Kohlenhydraten (Lactose, Oligosaccharide) mit 77 (47) g/l und Protein mit 11 (31) g/l reduziert den Wassergehalt auf 897 g/l bei einer Dichte von 1026 g/l [Geigy Scientific Tables. In: Physical Chemistry (Lentner C, ed.), Vol 3, Ciba-Geigy, Basel 1984 (S. 213)]. Man kann die Muttermilch daher auch bezeichnen als “die perfekte Lösung der Natur, ein Stück Butter in flüssiger Form anzubieten, weil der Säugling weder abbeißen noch kauen kann (J.S.).“
Als „kranke Idee“ wird eine Entwicklung in England (Eiscreme aus Muttermilch) und in den USA (Handel mit roher Muttermilch für Erwachsene) unter Bezug auf einen Bericht im Journal of the Royal Society of Medicine 2015 bezeichnet (Süddeutsche Zeitung vom 18.06.15).
Kokosmilch
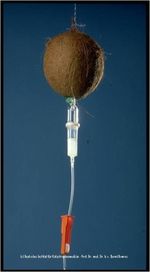
In DIE ZEIT Nº 14 aus dem Jahre 2006 wurde in der Rubrik „Stimmt’s?“ die Frage gestellt: „Wurde während des Zweiten Weltkrieges Verwundeten tatsächlich Kokosmilch infundiert, um die Transfusion von Blut zu ersetzen?“
Zitate aus der Antwort von Christoph Drösser: "Kokosmilch … fand tatsächlich …im Zweiten Weltkrieg, genauer gesagt an der pazifischen Front, in Notzeiten als Plasma-Ersatz Verwendung. Zwei Eigenschaften prädestinieren das Kokoswasser dazu: Erstens ist es steril, eine Seltenheit in tropischen Dschungeln, und zweitens ist es isotonisch…." Das folgende Bild (überlassen mit freundlicher Genehmigung durch Prof. Dr. Dr. Bernd Domres, Deutsches Institut für Katastrophenmedizin GmbH, Tübingen) charakterisiert die entstandene Situation.
Nachtrag (07.09.2015): Für Interessierte folgende Literaturstelle:
Campbell-Falck D, Thomas T, Falck TM, Tutuo N, Clem K:
The intravenous use of coconut water.
Am J Emerg Med 2000; 18: 108 - 11
Alkoholfreies Bier
„Bitburger 0,0 % alkoholfreies Pils“ wird im Internet wie folgt beworben: "Das einzige isotonische Alkoholfrei mit 0,0 % Alkohol".
Unter FAQ – häufig gestellte Fragen erhält man folgende Auskunft:
Was bedeutet eigentlich „isotonisch“?
„Isotonisch“ kommt aus dem Griechischen: „isos“ bedeutet „gleich“, „tonus“ bedeutet „Druck“. Isotonische Getränke haben die gleiche Menge an gelösten Inhaltsstoffen, wie das menschliche Blut. Das bedeutet, dass nach sportlichen oder nach körperlichen Aktivitäten dem Körper durch isotonische Getränke schnellstmöglich Energie, Mineralstoffe, Vitamine und Wasser zurückgegeben werden. Die wertvollen Stoffe eines isotonischen Getränks sind für den Körper (Muskeln, Organe etc.) rasch verfügbar.
Eine Nachfrage unter „Verbraucheranfragen“ zum Thema Qualitätskontrolle ergibt:
Alkoholfreie Biere sind nicht per se isotonisch, sondern unterscheiden sich je nach Herstellungsverfahren, es gibt auch andere alkoholfreie, isotonische Biere, die aber einen Alkoholgehalt über 0,0 vol% aufweisen. Bei Bitburger 0,0 % erreichen wir Isotonie bei 0,0 vol% Alkohol durch unser spezielles Brauverfahren. In der Kombination von Isotonie, Vitaminhaltigkeit und 0,0 % Alkohol ist Bitburger 0,0 % auf dem deutschen Markt bisher einzigartig.
Zum Thema teilt das Zentrallabor Bitburger Braugruppe GmbH (54634 Bitburg) mit: Von jeder abgefüllten Produktcharge wird die Osmolalität zur Sicherstellung der Isotonie mittels Osmometer (Gefrierpunktserniedrigung) bestimmt.
Tatsächlich ist die Osmolalitäts-Bestimmung ein sehr empfindlicher Messwert zur Kontrolle einer Alkohol- (ETOH-) Intoxikation: Bereits eine Blut-ETOH-Konzentration von 1 ‰ verursacht eine osmolale Lücke im Plasma von 32,0 mosmol/kg H2O, d. h., der Messwert der Osmolalität liegt um 32,0 mosmol/kg H2O über dem berechneten Wert.
Im gleichen Sinne kann die Osmolalitäts-Bestimmung zur Kontrolle der Alkohol-Konzentration im Bier verwendet werden:
1 vol% ETOH im Bier entspricht 197,2 mosmol/kg H2O, bzw. 0,1 vol% ≈ 20 mosmol/kg H2O (unter Verwendung des Mw von ETOH von 46,07, der Dichte von 0,79 g/l und dem vorläufigen osmotischen Koeffizienten von 1,15). Es ist beeindruckend, wie empfindlich man die ETOH-Quantität über die gemessene Osmolalität kontrollieren kann.
Isotone Sportgetränke
Die Auskunft der Bitburger Braugruppe (s.o.) führt zu einem zu prüfenden Nebenaspekt der Isotonie: „Das bedeutet, dass nach sportlichen oder nach körperlichen Aktivitäten dem Körper durch isotonische Getränke schnellstmöglich Energie, Mineralstoffe, Vitamine und Wasser zurückgegeben werden; die wertvollen Stoffe eines isotonischen Getränks sind für den Körper (Muskeln, Organe etc.) rasch verfügbar; isotonische Getränke … werden am schnellsten absorbiert, ….“
Deutsche Sporthochschule Köln
Für die isotonen Sportgetränke findet sich in der Werbung die gleiche Argumentation, daher wurde bei der Deutschen Sporthochschule in Köln (DSHS) nachgefragt. Insgesamt drei Mitarbeiter und der Pressesprecher der DSHS konnten die Frage nach dem wissenschaftlichen Hintergrund von isotonen Sportgetränken leider nicht lösen, nur soviel: „Sportgetränke sollten … vorzugsweise zwischen 270 und 330 mosmol/l liegen".
Adelholzener
Die Firma Adelholzener Alpenquellen (83313 Siegsdorf) bewirbt einen Teil ihrer Getränke mit dem Slogan: Die Adelholzener Sportgetränke sind isotonisch und kalorienarm (Adelholzener Orange Sport, Lemon Sport, Pink Grapefruit Sport, Kirsche Sport). Auf Nachfrage teilt der Leiter des Qualitätsmanagements mit, dass die Qualitätskontrolle von einem externen Labordienstleister über die Messung der Gefrierpunkts-Depression (Osmometrie, PhEur. 4.00/202.35.00) durchgeführt wird. Nach einem niemals umgesetzten Entwurf der EU-Kommission von 2004 zur sogenannten Sportgetränkerichtlinie wurde definiert, 270 - 330 mosmol/kg H2O gilt als isotonisch. Dieser Entwurf enthielt keinen Hinweis darauf, welche Vorteile sich aus der Isotonie von Sportgetränken ergeben sollten.
Deutsche Gesellschaft für Ernährungsmedizin (DGEM)
Der Versuch, wissenschaftliche Argumente für den Einsatz isotonischer Getränke bei der DGEM zu erhalten, schlug leider fehl. Anfragen bei diversen Experten der DGEM führten nicht weiter. Aktuelle Leitlinien der DGEM, in denen man Hinweise auf die Osmolalität enteraler Nährlösungen vermuten könnte, enthielten leider keine derartigen Formulierungen:
Weder die S-3-Leitlinie der DGEM „Besonderheiten der Überwachung bei künstlicher Ernährung“ aus dem Jahre 2013 (W. H. Hartl et al.) noch die S1-Leitlinie „Enterale und parenterale Ernährung von Patienten mit Niereninsuffizienz“ aus dem Jahre 2015 (W. Druml et al.) gaben hierzu irgendeinen Hinwies. Gerade letztere Leitlinie wäre doch dafür prädestiniert gewesen. Ein Fortbildungsbeitrag für Anästhesisten zur „Ernährung in der Intensivmedizin“ aus dem Jahre 2012 hilft hier leider auch nicht weiter (M. Hecker et al.).
Fazit zur Isotonie von Sportgetränken und enteralen Ernährungslösungen
Bisher konnte keine wissenschaftliche Begründung dafür gefunden werden, warum die Inhaltsstoffe isotonischer Getränke oder Ernährungslösungen vom Körper besonders schnell resorbiert und damit dem Körper zur Verfügung gestellt werden sollten.
Isotone Infusionslösungen
Derzeitige Deklarierung
Die derzeitige Praxis besteht – mit Ausnahmen – darin, die theoretische Osmolarität (mosmol/l), berechnet aus der molaren Zusammensetzung, für die jeweilige Infusionslösung zu deklarieren.
Als erste Ausnahme wird eine Lösung genannt, Geloplasma Infusionslösung 3 % Gelatine (Fresenius Kabi Austria), die mit der berechneten Osmolalität von 295 mosmol/kg H2O deklariert wird.
Als zweite Ausnahme soll eine Lipidlösung mit geändertem Wassergehalt beschrieben werden: Der Hersteller deklariert hier die gemessene Osmolalität mit 290 - 320 mosmol/kg für Lipofundin 10 % N und für Lipofundin 20 % N eine gemessene Osmolalität von 350 - 380 mosmol/kg (Braun Melsungen), weil hier der Wassergehalt deutlich reduziert wurde.
Hier wurden gemessene Osmolalitätswerte angegeben.
Osmolalität in vivo versus in vitro
Leider kann zwischen der in vitro gemessenen Osmolalität einer Infusionslösung und ihrer Wirkung in vivo – wie oben beschrieben – ein Unterschied bestehen, was an einigen Beispielen erläutert werden soll.
Der einfachste Fall ist die 5 %ige Glukose-Lösung (s. o.): Sie enthält theoretisch 278 mmol gleich mosmol pro Liter Lösung, also eine Osmolarität von 278 mosmol/l (Beispiel: Glukosteril 5 % Infusionslösung, Fresenius Kabi). Unter Berücksichtigung des Wassergehaltes von 97 % und einem osmotischen Koeffizienten von 1,013 (deutlich abweichend von NaCl) ergibt dies eine reale Osmolaliät von 290 mosmol/kg H2O, also eine eindeutig isotone Lösung, mehrfach in vitro gemessen. Die Infusion dieser Lösung aber hat eine Wirkung wie reines Wasser, weil die Glukose schnell intrazellulär im Gewebe metabolisiert wird und das Wasser extrazellulär zurückbleibt.
Würde eine Infusionslösung einen Zusatz von je 5 mosmol/kg H2O von Glukose oder Harnstoff erhalten, so würde dies einer Osmolaliät von – zusätzlich – je 5 mosmol/kg H2O entsprechen, weil das Plasma diese beiden Komponenten auch enthält und beide Substanzen im Konzentrations-Gleichgewicht mit dem Intrazellularraum stehen. Enthält eine Infusionslösung als Bikarbonat-Ersatz 24 mmol/l Azetat, dann ändert dies an der Osmolalität nichts, weil der intrazelluläre Metabolismus von Laktat oder Azetat eine äquimolare Freisetzung von 24 mmol/l Bikarbonat verursacht. Die Osmolaliät dieser Lösung wird also nicht verändert, also entspricht der Messwert in vitro der Wirkung in vivo.
Enthält eine Lösung als Bikarbonat-Ersatz hingegen z. B. 5 mmol/l Malat, dann wird die Osmolalität nach dem Metabolismus von Malat um 5 mosmol/l erhöht, weil pro mol Malat zwei mol Bikarbonat freigesetzt werden.
Enthält eine Infusionslösung hingegen einen Zusatz von Laktat, z.B. 20 mmol/l, dann entspricht die in vivo-Osmolalität dem in vitro-Wert, weil im oxidativen Metabolismus aus einem mol Laktat ein mol HCO3 gebildet wird. Wird das Laktat aber im hepatischen Metabolismus zur Glukoneogenese eingesetzt, dann wird die Osmolalität um 10 mosmol/kg H2O reduziert, weil aus 20 mmol Laktat gerade 10 mmol Glukose entstehen.
Für die hypoosmolale Ringer-Laktat-Lösung mit ihren 27 mmol/l Laktat bedeutet dies, dass die Osmolalität um 14 mosmol/kg H2O (aufgerundet) gesenkt wird, wenn das Laktat in der Leber zur Glukoneogenese eingesetzt wird; damit fällt dann die in vivo-Osmolalität von 256 auf 242 mosmol/kg H2O.
Details finden sich unter Osmolalität in vivo versus in vitro.
Gemessene statt berechnete Osmolalität von Infusionslösungen
Prinzipiell wäre zu überlegen, die bisher genannten berechneten Werte der Osmolalität durch kryoskopische Messwerte der GPE zu ersetzen. Dagegen sprechen zwei Argumente. Erstens werden mit der gemessenen Osmolalität die in vitro (Labor) und nicht die in vivo (Patient) Werte beschrieben. Zweitens haben eigene Versuche zu folgendem, vorläufigen Ergebnis geführt: Während die mittlere Abweichung der gemessenen Osmolalität im Vergleich zur theoretischen bei den 3 klassischen Präparaten (Plasma, 0,9 % NaCl und 5 % Glukose) eine mittlere Abweichung von weniger als 1 % ergeben hat (n = 102), zeigt diese bei 5 HES-Lösungen eine mittlere Überschätzung von fast 3 %. Diese atypische Abweichung kann vorläufig nur mit einem spezifischen "kryoskopischen HES-Effekt" erklärt werden, weshalb die Kryoskopie vorläufig bei den kolloidalen Lösungen nur mit Vorbehalt einsetzbar ist. Es wäre wünschenswert, wenn die Hersteller dieser Lösungen valide Messwerte zur Thematik beitragen könnten. Bis dahin sollte, wegen dieser zwei Argumente, der berechneten in vivo Osmolalität der Vorzug gegeben werden.
Beispiele für angeblich isotone Infusionslösungen
Verständlicherweise sind die Hersteller von Infusionslösungen daran interessiert, möglichst isotone Lösungen anzubieten. Aus einem Physioklin-Beitrag vom Juli 2009 werden folgende Beispiele zitiert und durch weitere ergänzt:
- ELO-MEL Isotone Infusionslösung (Fresenius Kabi Austria) wird mit einer Osmolarität von 302 mosmol/l deklariert, die berechnete Osmolalität beträgt 280 mosmol/kg H2O.
- Voluven 6 % balanced (Fresenius Kabi Schweiz) wird mit einer theoretischen Osmolarität von 286,5 mosmol/l deklariert, die berechnete Osmolalität beträgt 278 mosmol/kg H2O.
- Gelafusal (Serumwerk Bernburg) wird in der Fachinformation mit einer Osmolarität von 279 mosmol/l deklariert, aus der tatsächlichen Osmolarität von 249 mosmol/l (Addition der Osmole) ergibt sich eine Osmolalität von 239 mosmol/kg H2O.
- Beim Vitafusal (Serumwerk Bernburg) wird die theoretische Osmolarität mit 277 mosmol/l deklariert, die Osmolalität beträgt 269 mosmol/kg H2O.
- Die Plasmalyt-Infusionslösung (Baxter Austria) wird mit einer Osmolarität von 295 mosmol/l deklarier und erhält damit eine Osmolalität von 274 mosmol/kg H2O.
- Geloplasma Infusionslösung 3 % Gelatine (Fresenius Kabi Austria) wird mit der Osmolalität von 295 mosmol/kg H2O deklariert, der tatsächliche Wert beträgt nur 271 mosmol/kg H2O.
Zusammenfassend kann man feststellen, dass die Zahl der „nicht optimal“ deklarierten Lösungen auch deutlich hypotone Osmolalitätswerte von 239 - 280 mosmol/kg H2O aufweist.
Optimale isotone und balancierte Infusionslösungen
Es muss an dieser Stelle darauf hingewiesen werden, dass es heute durchaus möglich ist, die Osmolalität einer Infusionslösung ohne Probleme auf 288 mosmol/kg H2O einzustellen, dazu müssen nur andere, neutral metabolisierbare Substanzen eingesetzt werden (z. B. Arginin-Azetat, -Laktat etc.). Derartige Lösungen können dann auch mit den Plasma-Normalwerten (mmol/l) ausgestattet werden: BEpot (0), Natrium (142), Kalium (4,5) und Chlorid (103). Es bleibt abzuwarten, wann die Hersteller diesen Weg – endlich – beschreiten.
Fazit
- Isotonie ist die Gemeinsamkeit von Muttermilch, Kokosmilch, speziellem alkoholfreiem Bier, intensiv beworbenen Sportgetränken und optimalen Infusionslösungen.
- Isotonie wird synonym beschrieben als isoosmotisch oder isoton.
- Isoosmotisch ist eine Lösung dann, wenn ihre über die Gefrierpunktsdepression gemessene Osmolalität im Idealfalle 288 mosmol/kg H2O beträgt.
- Die Behauptung, isotonische Getränke würden am schnellsten resorbiert, bedarf dringend einer wissenschaftlichen Begründung oder Widerlegung.
- Die Deklarierung von Infusionslösungen sollte die Tatsache berücksichtigen, dass ein Unterschied zwischen der in vitro- (Labor) und in vivo- (Patient) Osmolalität bestehen kann.
- Es ist dringend geboten, die herkömmliche Praxis, Infusionslösungen über die theoretische (berechnete) Osmolarität (mosmol/l) zu deklarieren, durch die berechnete, in vivo-Osmolalität (mosmol/kg H2O) abzulösen.
- Einige im Markt befindliche, bezüglich ihrer vermeintlichen Isotonie falsch deklarierte Infusionslösungen, sollten möglichst bald richtig deklariert werden.
